题目内容
【题目】Na2FeO4、Li4YiO12和LiFePO4均可用作电极材料。请回答下列问题:
⑴基态Fe3+的价层电子轨道表达式为________;同周期元素中,基态原子的未成对电子数与基态Fe3+相同的元素为________。
⑵PO43-的空间构型为________,其中P原子的杂化方式为________;写出一种与PO43-互为等电子体且中心原子与P不同主族的阴离子:________(填离子符号)。
⑶[Ti(H2O)6]Cl3为紫色晶体,其中1mol阳离子中所含δ键的数目为________;配位键中提供孤电子对的原子为________(填元素符号)。
⑷已知物质间的转化关系如图甲所示,其中a、c均大于0。
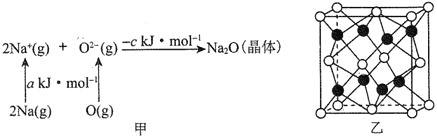
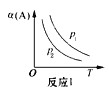
①基态Na原子的第一电离能可表示为________。
②相同条件下,Li2O的晶格能________(填“>”“<”或“=”)ckJmol-1,原因为________________________________。
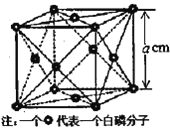
③Na2O的立方晶胞结构如图乙所示。若紧邻的两个Na+之间的距离为d pm,阿伏加德罗常数的值为NA,晶体的密度为ρ gcm-3,则Na的摩尔质量可表示为_______gmol-1(用含有d、ρ、NA的代数式表示)。
【答案】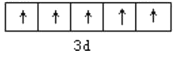 Mn 正四面体形 sp3 SO42-、SeO42-、ClO4-、BrO4-、IO4-等(任写一种即可) 18NA(或18×6.02×1023) O
Mn 正四面体形 sp3 SO42-、SeO42-、ClO4-、BrO4-、IO4-等(任写一种即可) 18NA(或18×6.02×1023) O ![]() kJmol-1 > Na2O和Li2O均为离子晶体,Na+的半径大于Li+的半径,故Na2O的晶格能小于Li2O的晶格能
kJmol-1 > Na2O和Li2O均为离子晶体,Na+的半径大于Li+的半径,故Na2O的晶格能小于Li2O的晶格能 ![]()
【解析】
⑴基态Fe3+的价层电子为3d5,写出轨道表达式,未成对电子有5个。
⑵PO43-有4对成键电子对,无孤电子对,其空间构型为正四面体形;根据 P3-= Cl- =S2-寻找与PO43-互为等电子体的离子。
⑶1个H2O中含有2个δ键,Ti和H2O形成6个δ键。
⑷①根据图甲可知,基态2Na原子的失去电子吸收a kJmol-1;②相同条件下,由于Na2O和Li2O均为离子晶体,Na+的半径大于Li+的半径,故Na2O的晶格能小于Li2O的晶格能;③根据图乙知,一个晶胞中含有钠原子和氧原子,可把晶胞分为8个小立方体,根据密度公式进行表达,再计算。
⑴基态Fe3+的价层电子为3d5,其轨道表达式为 ;基态原子的未成对电子数与基态Fe3+相同的元素为Mn;故答案为:
;基态原子的未成对电子数与基态Fe3+相同的元素为Mn;故答案为: ;Mn。
;Mn。
⑵PO43-有4对成键电子对,无孤电子对,其空间构型为正四面体形,其中P原子的杂化方式为sp3;与PO43-互为等电子体且中心原子与P不同主族的阴离子有SO42-、SeO42-、ClO4-、BrO4-、IO4-等,故答案为:正四面体形;sp3;SO42-、SeO42-、ClO4-、BrO4-、IO4-等(任写一种即可)。
⑶[Ti(H2O)6]Cl3为紫色晶体,1个H2O中含有2个δ键,Ti和H2O形成6个δ键,故1mol [Ti(H2O)6] 3+离子中所含δ键的数目为18NA(或18×6.02×1023);配位键中提供孤电子对的原子为O,故答案为:18NA(或18×6.02×1023);O。
⑷①根据图甲可知,基态Na原子的第一电离能为![]() kJmol-1,故答案为:
kJmol-1,故答案为:![]() kJmol-1。
kJmol-1。
②相同条件下,由于Na2O和Li2O均为离子晶体,Na+的半径大于Li+的半径,故Na2O的晶格能小于Li2O的晶格能,故答案为:>;Na2O和Li2O均为离子晶体,Na+的半径大于Li+的半径,故Na2O的晶格能小于Li2O的晶格能。
③根据图乙知,一个晶胞中含有8个钠原子和![]() 个氧原子,可把晶胞分为8个小立方体,由于紧邻的两个
个氧原子,可把晶胞分为8个小立方体,由于紧邻的两个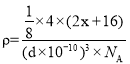 ,则
,则![]() ,故答案为:
,故答案为:![]() 。
。

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
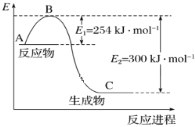
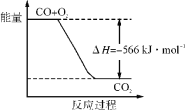
(1)上图是![]() 和
和![]() 反应生成
反应生成![]() 过程中能量的变化示意图,下列有关说法正确的是_______。
过程中能量的变化示意图,下列有关说法正确的是_______。
a. 反应物的总能量比生成物的总能量高
b. 反应物的活化能比生成物的活化能高
c. 反应物的总键能比生成物的总键能高
d. 该反应为熵增反应
(2)请写出![]() 和
和![]() 反应的热化学方程式:_______,决定该反应进行方向的主要判据为________。
反应的热化学方程式:_______,决定该反应进行方向的主要判据为________。
(3)试根据表中及图中数据计算![]() 的键能______________ kJ/mol;
的键能______________ kJ/mol;
化学键 |
|
|
键能/ kJ/mol | 390 | 943 |
(4)用![]() 催化还原
催化还原![]() 还可以消除氮氧化物的污染。已知:
还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=-akJ/mol
N2(g)+O2(g)=2NO(g);△H2=-bkJ/mol
若1molNH3还原NO至N2,则该反应过程中的反应热△H3=_____________kJ/mol(用含a、b的式子表示)。