题目内容
【题目】太阳能电池板材料除单晶硅外,还有氮、硼、硒、钛、钴、钙等元素组成的化学物质。
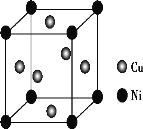
⑴钙原子基态时的电子排布式为____________________,金属钴堆积方式与镁相似,都属于六方最密堆积,其配位数是____。
⑵氮元素的第一电离能在同周期中(稀有气体除外)从大到小排第___位;写出与NO3-互为等电子体的一种非极性分子的化学式__________。
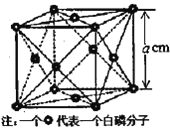
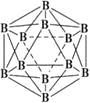
⑶晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),其中有两个原子为10B,其余为11B,则该结构单元有_____________种不同的结构类型。己知硼酸(H3BO3)为一元弱酸,解释其为一元弱酸的原因______________。硼酸的结构与石墨相似,层内的分子以氢键相连,含1 mol硼酸的晶体中有___mol氢键。
⑷硒是动物体必需的营养元素。SeO2是硒的重要化合物,SeO2的价层电子对互斥模型是_______________。
⑸在浓的TiCl3的盐酸溶液中加入乙醚,并通入HC1至饱和,可得到配位数为6,组成为 TiCl36H2O的晶体,该晶体中两种配体的物质的量之比为1:5,则该配离子的化学式为:__________________。
⑹钴晶体的一种晶胞是一种体心立方结构(如图所示),若该晶胞的边长为a nm,密度为ρ gcm-3,NA表示阿伏加德罗常数的值,则钴的相对原子质量可表示为_________________。

【答案】1s22s22p63s23p64s2 12 2 SO3等 3 H3BO3与一个水分子可形成配位键,电离产生[B(OH)4]-和一个H+ 3 平面三角形 [TiCl(H2O)5]2+ ![]()
【解析】
⑴钙为20号元素,其核外有20个电子,金属钴堆积方式与镁相似。
⑵同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于同周期相邻元素的,S = O = N-,容易写出与NO3-互为等电子体的一种非极性分子。
⑶两个10B有3位置,为上下顶点位置,其中一个处于上顶点,另外的一个处于上层阴影中顶点,或者下层阴影中顶点,有3种结构,H3BO3与一个水分子可形成配位键,电离产生[B(OH)4]-和一个H+,则硼酸一元弱酸;1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1 mol H3BO3的晶体中有3mol氢键。
⑷ SeO2分子中价层电子对个数= δ键个数![]() 孤电子对个数。
孤电子对个数。
⑸在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl36H2O的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个![]() 、5个H2O,2个氯离子位于外界。
、5个H2O,2个氯离子位于外界。
⑹先计算晶胞中钴原子的数目,根据密度公式,得出钴的相对原子质量。
⑴钙为20号元素,其核外有20个电子,则钙原子基态时的核外电子排布式为1s22s22p63s23p64s2,金属钴堆积方式与镁相似,都属于六方最密堆积,其配位数是12,
故答案为:1s22s22p63s23p64s2;12。
⑵同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于同周期相邻元素的,故第二周期第一电离能:F > N > O > C > Be > B > Li,原子数目相等、价电子总数也相等的微粒互为等电子体,与NO3-互为等电子体的一种非极性分子为SO3等;故答案为:2;SO3等。
⑶两个10B有3位置,为图中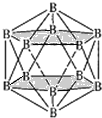 上下顶点位置,其中一个处于上顶点,另外的一个处于上层阴影中顶点,或者下层阴影中顶点,有3种结构,H3BO3与一个水分子可形成配位键,电离产生[B(OH)4]-和一个H+,则硼酸一元弱酸;1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1 mol H3BO3的晶体中有3mol氢键;故答案为:3;H3BO3与一个水分子可形成配位键,电离产生[B(OH)4]-和一个H+;3。
上下顶点位置,其中一个处于上顶点,另外的一个处于上层阴影中顶点,或者下层阴影中顶点,有3种结构,H3BO3与一个水分子可形成配位键,电离产生[B(OH)4]-和一个H+,则硼酸一元弱酸;1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1 mol H3BO3的晶体中有3mol氢键;故答案为:3;H3BO3与一个水分子可形成配位键,电离产生[B(OH)4]-和一个H+;3。
⑷ SeO2分子中价层电子对个数= δ键个数![]() 孤电子对个数=
孤电子对个数= ![]() ,则其价层电子对互斥模型为平面三角形,故答案为:平面三角形。
,则其价层电子对互斥模型为平面三角形,故答案为:平面三角形。
⑸在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl36H2O的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个![]() 、5个H2O,2个氯离子位于外界,则该配离子的化学式为[TiCl(H2O)5]2+;故答案为:[TiCl(H2O)5]2+。
、5个H2O,2个氯离子位于外界,则该配离子的化学式为[TiCl(H2O)5]2+;故答案为:[TiCl(H2O)5]2+。
⑹晶胞中钴原子的数目为![]() ,根据密度
,根据密度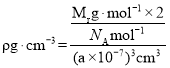 ,得出钴的相对原子质量为
,得出钴的相对原子质量为![]() ;故答案为:
;故答案为:![]() 。
。

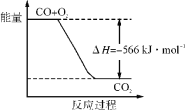
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
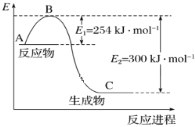
(1)上图是![]() 和
和![]() 反应生成
反应生成![]() 过程中能量的变化示意图,下列有关说法正确的是_______。
过程中能量的变化示意图,下列有关说法正确的是_______。
a. 反应物的总能量比生成物的总能量高
b. 反应物的活化能比生成物的活化能高
c. 反应物的总键能比生成物的总键能高
d. 该反应为熵增反应
(2)请写出![]() 和
和![]() 反应的热化学方程式:_______,决定该反应进行方向的主要判据为________。
反应的热化学方程式:_______,决定该反应进行方向的主要判据为________。
(3)试根据表中及图中数据计算![]() 的键能______________ kJ/mol;
的键能______________ kJ/mol;
化学键 |
|
|
键能/ kJ/mol | 390 | 943 |
(4)用![]() 催化还原
催化还原![]() 还可以消除氮氧化物的污染。已知:
还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=-akJ/mol
N2(g)+O2(g)=2NO(g);△H2=-bkJ/mol
若1molNH3还原NO至N2,则该反应过程中的反应热△H3=_____________kJ/mol(用含a、b的式子表示)。