题目内容
12.一定温度下,反应N2(g)+3H2(g)?2NH4(g)达到化学平衡状态的标志是( )| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2倍 | |
| D. | 单位时间里每增加1molN2,同时消耗2molNH2 |
分析 化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理量不再变化,注意反应化学方程式中气体的化学计量数之和前后不等的特点,以此判断.
解答 解:A、N2、H2和NH3的质量分数不再改变,说明达到平衡状态,故A正确;
B、平衡时各物质的浓度取决于反应开始时的配料比以及反应转化的程度,不能用来判断是否达到平衡状态,故B错误;
C、反应达到平衡时,氮气与H2的物质的量之和是NH3的物质的量2倍也可能不是NH3的物质的量2倍,这与该反应的初始物质的量及转化率有关,故C错误;
D、无论反应是否达到平衡状态,只要单位时间里每增加1molN2,同时减少2molNH3,所以不能用来判断该反应达到平衡状态,故D错误.
故选A.
点评 本题考查化学平衡状态的判断,题目难度不大,注意方程式中气体的化学计量数关系,注意平衡时的浓度关系、物质的量关系不能作为判断是否平衡的依据.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
2.下列各物质中均能导电且导电本质不同的是( )
| A. | 石墨和稀硫酸 | B. | 金属铝和金属铜 | ||
| C. | 金刚石和晶体硅 | D. | 液态HCl和液态NaCl |
20.关于如图所示铜锌原电池的说法正确的是( )
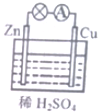

| A. | 原电池的反应本质是氧化还原反应 | B. | 电子由Cu片通过导线流向锌片 | ||
| C. | 正极反应式为Zn-2e=Zn2+ | D. | Cu为负极,Zn为正极 |
17.关于化学反应中的能量变化,下列说法中不正确的是( )
| A. | 燃烧反应都是放热反应 | |
| B. | 对于可逆反应:aA(g)+bB(g)?bC(g)+dD(g),如果正反应放热,逆反应一定吸热 | |
| C. | 氢气燃烧生成水是一个放热的化学反应,说明1mol H2的能量高于1mol H2O的能量 | |
| D. | 石墨转化为金刚石需要吸收能量,所以石墨的化学性质更稳定 |
4.下列事实中能说明醋酸是弱电解质的是( )
| A. | 醋酸溶液作导电试验,灯光较暗 | |
| B. | 醋酸(CH3COOH)是共价化合物 | |
| C. | 醋酸不与氯化钠反应 | |
| D. | 常温下1mol.L-1醋酸溶液的c(H+)约为0.004mol•L-1 |
1.下列化学性质叙述或有关化学反应表达正确的是( )
| A. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| B. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 除去乙烷中混有的乙烯的方法是通氢气在一定条件下反应,使乙烯转化为乙烷 |
2.电解法是处理工业废水的一种重要方法.如酸性含(Cr2O72-)废水就可以采用电解法进行无害化处理.电解时采用Fe作阳极,惰性电极作阴极.已知:①氧化性:Cr2O72->Fe3+;②Cr2O72-被还原生成Cr3+;③Ksp[Cr (OH)3]=6.3×10-31.下列说法正确的是( )
| A. | 阳极材料也可以是Cu | |
| B. | 阴极每产生3molH2,则有1mol Cr2O72-被还原 | |
| C. | 一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀 |
 (1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的物质的量随时间的变化如图 所示.
(1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的物质的量随时间的变化如图 所示. 原电池是把化学能转化为电能的装置,请回答下列问题:
原电池是把化学能转化为电能的装置,请回答下列问题: