题目内容
2.下列各物质中均能导电且导电本质不同的是( )| A. | 石墨和稀硫酸 | B. | 金属铝和金属铜 | ||
| C. | 金刚石和晶体硅 | D. | 液态HCl和液态NaCl |
分析 能导电的物质中含有自由电子或自由移动的离子,金属单质、熔融状态下的电解质及可溶性电解质溶液都能导电,据此分析解答.
解答 解:A.石墨中含有自由移动的电子而能导电,稀硫酸中含有自由移动的离子而能导电,所以导电本质不同,故A正确;
B.铝和铜都是金属单质,因为含有自由移动的电子而能导电,导电本质相同,故B错误;
C.金刚石和晶体硅都是原子晶体,不含自由移动电子或离子,所以不能导电,故C错误;
D.液态HCl中不含自由移动的离子或电子,所以不能导电,液态氯化钠中含有自由移动的离子,所以能导电,故D错误;
故选A.
点评 本题考查物质导电性,侧重考查分析判断能力,明确导电原理是解本题关键,注意液态HCl中只含HCl分子,所以不导电,为易错点.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
20.某有机物的结构简式如图所示,下列有关该有机物的说法正确的是( )
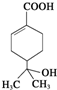

| A. | 分子中含有两种官能团 | |
| B. | 可使溴水和酸性高锰酸钾溶液褪色,且原理相同 | |
| C. | 能发生加成、取代、氧化、消去等反应 | |
| D. | 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
7.如表中各粒子、粒子对应的立体结构及解释均正确的是( )
| 分 子 | 立体结构 | 原 因 | |
| A | 甲醛(HCHO) | 平面三角形 | C原子采用sp2杂化且C原子的价电子均参与成键 |
| B | 三氯甲烷(CH3Cl) | 正四面体 | C原子采用sp3杂化且C原子的价电子均参与成键 |
| C | 铵根离子(NH4+) | 三角锥型 | N原子采用sp3杂化且4个N-H完全一样 |
| D | 水分子(H2O) | 直线型 | O原子采用sp3杂化但O原子有两对价电子未参与成键 |
| A. | A | B. | B | C. | C | D. | D |
11. 实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )
实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )
 实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )
实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )| A. | 产物在a中第一层 | |
| B. | a中有产物和水,还含HBr、Br2、CH3CH2OH等 | |
| C. | 反应过程中浓硫酸显示酸性、强氧化性、脱水性、难挥发性等性质 | |
| D. | 烧瓶中除发生取代反应可能发生消去反应、氧化还原反应等 |
12.一定温度下,反应N2(g)+3H2(g)?2NH4(g)达到化学平衡状态的标志是( )
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2倍 | |
| D. | 单位时间里每增加1molN2,同时消耗2molNH2 |