题目内容
4.下列事实中能说明醋酸是弱电解质的是( )| A. | 醋酸溶液作导电试验,灯光较暗 | |
| B. | 醋酸(CH3COOH)是共价化合物 | |
| C. | 醋酸不与氯化钠反应 | |
| D. | 常温下1mol.L-1醋酸溶液的c(H+)约为0.004mol•L-1 |
分析 强弱电解质的本质区别是电离程度,只有部分电离的电极是弱电解质,可以根据一定浓度溶液的pH、醋酸钠溶液的酸碱性等判断醋酸是弱电解质,据此分析解答.
解答 解:A.用醋酸溶液作导电实验,灯光较暗,说明溶液中离子浓度较低,不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故A错误;
B.电解质的强弱与电离程度有关,与共价化合物和离子化合物无关,故B错误;
C.醋酸不能与氯化钠反应,说明二者不符合复分解反应条件,不能说明醋酸是弱电解质,故C错误;
D.常温下1mol.L-1醋酸溶液的c(H+)约为0.004mol•L-1,氢离子浓度小于醋酸浓度,说明醋酸部分电离,则证明醋酸是弱电解质,故D正确;
故选D.
点评 本题考查弱电解质的判断,明确强弱电解质的概念是解本题关键,注意不能根据电解质溶液导电性、物质的溶解性、化合物类型等判断强弱电解质,注意电解质溶液导电性与离子浓度有关,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
15.下列元素中,原子半径最小的是( )
| A. | Na | B. | K | C. | Cl | D. | F |
12.一定温度下,反应N2(g)+3H2(g)?2NH4(g)达到化学平衡状态的标志是( )
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2倍 | |
| D. | 单位时间里每增加1molN2,同时消耗2molNH2 |
19.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化.下列说法正确的是( )
( )
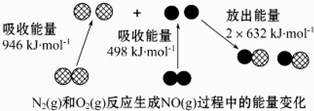
( )

| A. | 通常情况下,N2(g)和 O2混合能直接生成NO(g) | |
| B. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| C. | 1 mol N2(g)和1mol个 O2(g)反应放出的能量为180 kJ | |
| D. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
9.下列鉴别方法中,不能对二者进行鉴别的是( )
| A. | 用红外光谱法鉴别乙醇和二甲醚 | |
| B. | 用酸性高锰酸钾溶液鉴别乙烷和乙炔 | |
| C. | 用碘水鉴别苯和四氯化碳 | |
| D. | 用溴的四氯化碳鉴别乙烯和乙炔 |
13.化学反应A2+B2═2AB的能量变化如图所示,则下列说法正确的是( )


| A. | 因为该反应为放热反应,故不必加热反应就可发生 | |
| B. | 断裂1 mol A-A 键和1 mol B-B 键放出x kJ能量 | |
| C. | 断裂2 mol A-B 键需要吸收y kJ的能量 | |
| D. | 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
14.有机物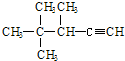 的系统名称为( )
的系统名称为( )
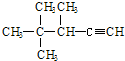 的系统名称为( )
的系统名称为( )| A. | 2,2,3-三甲基-1-戊炔 | B. | 3,4,4-三甲基-4-戊炔 | ||
| C. | 3,4,4-三甲基-1-戊炔 | D. | 2,2,3-三甲基-4-戊炔 |

 .
.