题目内容
3.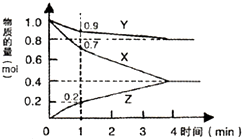 (1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的物质的量随时间的变化如图 所示.
(1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的物质的量随时间的变化如图 所示.由图中数据分析,该反应的化学方程式为3X+Y=2Z(用X、Y、Z表示),反应开始至lmin,X的平均反应速率为0.15mol/(L.min).若4min时反应达到最大限度,Z的物质的量等于0.4 mol.此时,X的转化率为60%,Y的物质的量浓度为0.4mol/L
(2)可逆反应:2N02(g)?2N0(g)+02(g),在体积不变的密闭容器中反应,达到平衡状态的标志是①④(填序号).
①单位时间内生成nmol02的同时生成2nmolN02
②单位时间内生成nmol02的同时生成2nmolNO
③用N02、N0、02的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态.
分析 (1)根据图象知,X、Y是反应物而Z是生成物,反应达到平衡状态时,参加反应的△n(X)=(1.0-0.4)mol=0.6mol、△n(Y)=(1.0-0.8)mol=0.2mol、△n(Z)=(0.4-0)mol=0.4mol,参加反应的各物质的物质的量变化量之比等于其计量数之比,所以X、Y、Z计量数之比=0.6mol:0.2mol:0.4mol=3:1:2,据此书写其化学方程式;
X的反应速率=$\frac{\frac{△n}{V}}{△t}$;
4min时,反应达到平衡状态,Z的物质的量为0.4mol,根据X和Z的关系式知,参加反应的X的物质的量为0.6mol,转化率=$\frac{参加反应的物质的量}{反应初始物质的量}×100%$;
根据Z和Y的关系式知,参加反应的Y的物质的量为0.2mol,则剩余Y的物质的量0.8mol,Y的物质的量浓度=$\frac{n}{V}$;
(2)反应达到平衡状态时正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变.
解答 解:(1)根据图象知,X、Y是反应物而Z是生成物,反应达到平衡状态时,参加反应的△n(X)=(1.0-0.4)mol=0.6mol、△n(Y)=(1.0-0.8)mol=0.2mol、△n(Z)=(0.4-0)mol=0.4mol,参加反应的各物质的物质的量变化量之比等于其计量数之比,所以X、Y、Z计量数之比=0.6mol:0.2mol:0.4mol=3:1:2,该反应的化学方程式为3X+Y=2Z;
X的反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.0mol-0.7mol}{2L}}{1min}$=0.15mol/(L.min);
4min时,反应达到平衡状态,Z的物质的量为0.4mol,根据X和Z的关系式知,参加反应的X的物质的量为0.6mol,转化率=$\frac{参加反应的物质的量}{反应初始物质的量}×100%$=$\frac{0.6mol}{1.0mol}×100%$=60%;
根据Z和Y的关系式知,参加反应的Y的物质的量为0.2mol,则剩余Y的物质的量0.8mol,Y的物质的量浓度=$\frac{n}{V}$=$\frac{0.8mol}{2L}$=0.4mol/L,
故答案为:3X+Y=2Z;0.15mol/(L.min);60%;0.4mol/L;
(2)反应达到平衡状态时正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,
①单位时间内生成nmol02的同时生成2nmolN02,正逆反应速率相等,反应达到平衡状态,故正确;
②无论反应是否达到平衡状态,都存在单位时间内生成nmol02的同时生成2nmolNO,所以不能据此判断平衡状态,故错误;
③无论反应是否达到平衡状态,都存在用N02、N0、02的物质的量浓度变化表示的反应速率的比为2:2:1的状态,不能据此判断平衡状态,故错误;
④混合气体的颜色不再改变的状态,说明二氧化氮浓度不变,则反应达到平衡状态,故正确;
⑤无论反应是否达到平衡状态,混合气体的密度始终不变,不能据此判断平衡状态,故错误;
故选①④.
点评 本题考查图象分析及平衡状态判断,侧重考查学生分析计算能力,明确物质的量变化量与计量数关系是解本题关键,注意只有反应前后改变的物理量才能作为平衡状态判断依据,题目难度中等.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案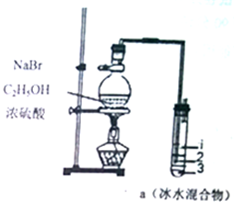 实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )
实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )| A. | 产物在a中第一层 | |
| B. | a中有产物和水,还含HBr、Br2、CH3CH2OH等 | |
| C. | 反应过程中浓硫酸显示酸性、强氧化性、脱水性、难挥发性等性质 | |
| D. | 烧瓶中除发生取代反应可能发生消去反应、氧化还原反应等 |
| A. | 燃料的燃烧反应都是放热反应 | |
| B. | -定量的燃料完全燃烧放出的热量比不完全燃烧放出的热量大 | |
| C. | 放热反应的逆反应一定是吸热反应 | |
| D. | 吸热反应没有应用价值 |
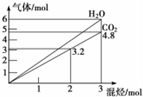 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )①可能有C2H2②一定有CH4③一定有C3H8④一定没有C2H4⑤可能有C2H4.
| A. | ②④ | B. | ②⑤ | C. | ③④ | D. | ②③ |
| A. | Na | B. | K | C. | Cl | D. | F |
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2倍 | |
| D. | 单位时间里每增加1molN2,同时消耗2molNH2 |

| A. | 因为该反应为放热反应,故不必加热反应就可发生 | |
| B. | 断裂1 mol A-A 键和1 mol B-B 键放出x kJ能量 | |
| C. | 断裂2 mol A-B 键需要吸收y kJ的能量 | |
| D. | 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
