题目内容
7. 原电池是把化学能转化为电能的装置,请回答下列问题:
原电池是把化学能转化为电能的装置,请回答下列问题:(1)原电池的正极得到(填“得到”或“失去”)电子,发生氧化(填“氧化”或“还原”)反应;负极失去(填“得到”或“失去”)电子,发生还原(填“氧化”或“还原”)反应.
(2)如图所示,若烧杯中溶液为稀硫酸,则观察到的现象是镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转,负极反应式为Mg-2e-=Mg2+若烧杯中溶液为氢氧化钠溶液,则负极为Al(填“Mg”或“A1”).
(3)把甲、乙、丙、丁四块金属浸在稀H2SO4中,用导线两两相连可以组成各种原电池,若甲、乙相连,甲的质量减少;丙、丁相连.丁上有气泡逸出,甲、丙相连,甲上发生氧化反应:乙、丁相连,乙是电子流入的一极,则四种金属的活泼型排序由强到弱排列为甲>丙>丁>乙.
分析 (1)原电池是化学能转化为电能的装置,活泼金属作负极,负极失电子发生氧化反应,正极得电子发生还原反应;
(2)若烧杯中溶液为稀硫酸,Mg能够与稀硫酸反应;若烧杯中溶液为氢氧化钠溶液,Al能够与NaOH溶液反应;
(3)原电池中,负极材料为较为活泼的金属,发生氧化反应,正极为较不活泼的金属,氢离子的正极上得电子发生还原反应生成氢气,电子从负极沿导线流向正极,以此判断金属的活动性.
解答 解:(1)原电池中活泼金属作负极,负极失电子发生氧化反应,正极得电子发生还原反应,故答案为:得到;还原;失去; 氧化;
(2)若烧杯中溶液为稀硫酸,该装置符合原电池构成条件,所以能构成原电池,则电流表指针发生偏转,Mg易失电子作负极、Al作正极,负极反应式为Mg-2e-=Mg2+、正极反应式为2H++2e-=H2↑,所以看到的现象是:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;若烧杯中溶液为氢氧化钠溶液,碱性条件下,Al易失电子作负极、Mg作正极,
故答案为:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;Mg-2e-=Mg2+;Al;
(3)原电池中,负极材料为较为活泼的金属,若甲、乙相连,甲质量减少为负极,所以甲的活泼性大于乙的活泼性;
丙、丁相连,丁上有气泡逸出,氢离子的正极上得电子发生还原反应生成氢气,所以丙的活泼性大于丁的活泼性;
甲、丙相连,甲上发生氧化反应,负极材料为较为活泼的金属,发生氧化反应,所以甲的活泼性大于丙的活泼性;
乙、丁相连,乙是电子流入的一极,电子从负极沿导线流向正极,所以丁的活泼性大于乙的活泼性;
所以则四种金属的活泼性顺序由大到小排列为甲>丙>丁>乙,故答案为:甲>丙>丁>乙.
点评 本题考查原电池的工作原理以及金属活动性的比较,题目难度不大,注意金属活动性的比较方法的积累来解答.

| A. | 燃料的燃烧反应都是放热反应 | |
| B. | -定量的燃料完全燃烧放出的热量比不完全燃烧放出的热量大 | |
| C. | 放热反应的逆反应一定是吸热反应 | |
| D. | 吸热反应没有应用价值 |
| A. | Na | B. | K | C. | Cl | D. | F |
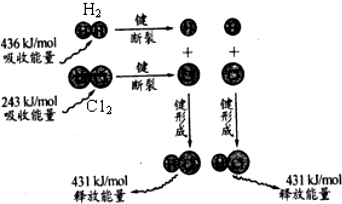
| A. | 该反应在光照和点燃条件下的反应热效应是相同的 | |
| B. | 氢气分子中的化学键比氯气分子中的化学键更稳定 | |
| C. | 2mol气态氢原子的能量低于1mol氢气 | |
| D. | 氢气与氯气反应的热化学方程式:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol |
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2倍 | |
| D. | 单位时间里每增加1molN2,同时消耗2molNH2 |
( )
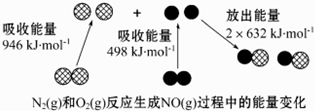
| A. | 通常情况下,N2(g)和 O2混合能直接生成NO(g) | |
| B. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| C. | 1 mol N2(g)和1mol个 O2(g)反应放出的能量为180 kJ | |
| D. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
 .
.
 ,肉桂醛分子结构中有6种不同化学环境的氢原子.
,肉桂醛分子结构中有6种不同化学环境的氢原子.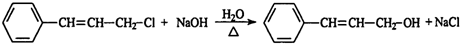 ,B转化为肉桂醛的反应条件为Cu/Ag加热.
,B转化为肉桂醛的反应条件为Cu/Ag加热. .
. .
.