题目内容
16.下列装置或操作能达到目的是( )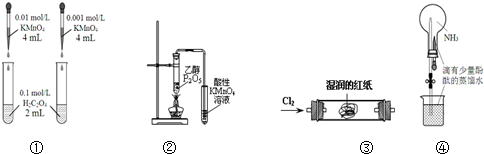
| A. | 装置①依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 装置②证明CH3CH2OH发生消去反应生成了乙烯 | |
| C. | 装置③观察红纸褪色证明氯气具有漂白性 | |
| D. | 打开装置④中的止水夹,挤出胶头滴管中的液体,可观察到红色的喷泉 |
分析 A.浓度不同其它条件相同时,根据溶液褪色快慢确定浓度对化学反应速率的影响;
B.乙醇能使酸性高锰酸钾褪色;
C.氯气无漂白性;
D.氨气极易溶于水.
解答 解:A.两种溶液中高锰酸钾溶液浓度不同,其它条件相同,所以可以根据溶液褪色时间判断浓度对反应速率的影响,故A正确;
B.乙醇易挥发,乙醇能使酸性高锰酸钾褪色,不一定是乙烯,故B错误;
C.氯气无漂白性,是氯水中的次氯酸有漂白性,故C错误;
D.氨气极易溶于水,可形成喷泉,碱性溶液遇酚酞呈红色,故D正确.
故选AD.
点评 本题考查化学实验方案评价,侧重考查基本操作、基本原理,明确实验原理是解本题关键,注意从装置的目的性、操作的准确性等方面评价,题目难度不大.

练习册系列答案
相关题目
6.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球与蒸馏烧瓶支管口在同一高度处 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后,还需加少量蒸馏水再趁热过滤 | |
| D. | 除去混在苯中的苯酚时,可先加入饱和浓溴水,振荡后静置,再过滤 |
7.下列说法正确的是( )
| A. | SiO2晶体易溶于水,水溶液呈现酸性 | |
| B. | CO2通入水玻璃中不可能得到硅酸 | |
| C. | SiO2是酸性氧化物,它不溶于任何酸 | |
| D. | SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑是制造玻璃的反应之一 |
4.下列各组离子一定能大量共存的是( )
| A. | Na+、K+、SO42-、Br- | B. | Fe3+、Mg2+、HCO3-、Cl- | ||
| C. | H+、K+、I-、ClO- | D. | Ag+、NH4+、NO3-、Cl- |
11.经测定,某溶液中只含有NH4+、Cl-、H+、OH-四种离子,下列说法中错误的是( )
| A. | 溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| B. | 若溶液中的溶质是NH4Cl和NH3•H2O,则不等式c(NH4+)>c(Cl-)>c(NH3•H2O)>c(H+)一定正确 | |
| C. | 若溶液中四种离子满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl | |
| D. | 若溶液中c(Cl-)=c(NH4+),则该溶液呈中性 |
1.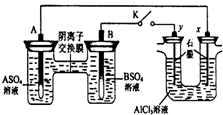 某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )
某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )
 某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )
某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )| A. | 溶液中(A2+)浓度减小 | |
| B. | B 的电极反应:B-2eˉ═B2+ | |
| C. | y 电极上有 H2 产生,发生还原反应 | |
| D. | 反应初期,x 电极周围出现白色胶状沉淀,不久沉淀溶解 |
8.某溶液中有Fe2+、Mg2+、Al3+、Fe3+等四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是( )
| A. | Fe2+ | B. | Mg2+ | C. | Al3+ | D. | Fe3+ |
5.如图,有关铁钉腐蚀(除②外,电解质溶液为食盐水)说法不正确的是( )
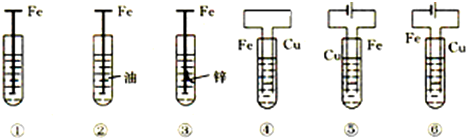

| A. | ③是牺牲阳极的阴极保护法 | |
| B. | 若将⑥的Cu极换成不溶性电极,则⑥是外加电流的阴极保护法 | |
| C. | 腐蚀快到慢的顺序为⑤>④>①>⑥>③>② | |
| D. | ①发生析氢腐蚀 |
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.56 L甲烷中含有的共价键数为0.1NA | |
| B. | 标准状况下,1mol SO3含有的氧原子数为3NA | |
| C. | 3mol NO2和足量H2O反应,转移1 NA个电子 | |
| D. | pH=1的稀硫酸中含有的H+数为0.1NA |