题目内容
11.经测定,某溶液中只含有NH4+、Cl-、H+、OH-四种离子,下列说法中错误的是( )| A. | 溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| B. | 若溶液中的溶质是NH4Cl和NH3•H2O,则不等式c(NH4+)>c(Cl-)>c(NH3•H2O)>c(H+)一定正确 | |
| C. | 若溶液中四种离子满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl | |
| D. | 若溶液中c(Cl-)=c(NH4+),则该溶液呈中性 |
分析 A、依据若溶液中溶质是大量氯化氢和少量氯化铵时,溶液中离子浓度大小分析判断;
B、溶质为氯化铵和氨水,当氨水大量时,溶液显示碱性时,则满足c(NH4+ )>c(NH3•H2O)>c(Cl-)>c(OH-)>c(H+ );
C、根据离子浓度关系可知,该溶液可能为氯化铵溶液,有可能为氯化铵和氯化氢的混合物;
D、依据溶液中电荷守恒分析判断.
解答 解:A、某溶液中只含NH4+、Cl-、H+、OH-四种离子,若溶液中溶质是大量氯化氢和少量氯化铵时,离子浓度大小为:c(Cl-)>c(H+)>c(NH4+)>c(OH-),故A正确;
B、若溶液中溶质是氯化铵和氨水,当氨水大量时,溶液显示碱性时,则满足c(NH4+ )>c(NH3•H2O)>c(Cl-)>c(OH-)>c(H+ ),所以不一定有c(NH4+)>c(Cl-)>c(NH3•H2O)>c(H+),故B错误;
C、由离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-)可知,溶质可能为氯化铵,有可能为氯化铵和氯化氢的混合物,所以溶液中溶质不一定只有氯化铵,故C错误;
D、当c(NH4+)=c(Cl-),根据溶液中电荷守恒c(H+)+c(NH4+)=c(OH-)+c(Cl-)可得,c(H+)=c(OH-),则溶液一定呈中性,故D正确;
故选BC.
点评 本题考查离子浓度大小比较、盐的水解原理,题目难度中等,注意一水合氨为弱电解质的特点以及从溶液电中性的角度分析,掌握电荷守恒、物料守恒在离子浓度大小比较中的应用.

练习册系列答案
相关题目
1.下列有关电解质溶液的说法正确的是( )
| A. | 将10 mL0.1 mol•L-1Na2CO3溶液逐滴滴加到10 mlL0.1 mol•L-1盐酸中,混合溶液中各离子浓度的大小关系:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | |
| B. | 物质的量浓度相等的NaF溶液和CH3COONa溶液相比较,两者离子的总浓度相等 | |
| C. | 向0.1mol•L-1的FeCl3溶液中滴加少量酸性KMnO4溶液,KMnO4溶液不褪色,说明FeCl3只有氧化性,无法被氧化剂氧化 | |
| D. | 将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3浓溶液,可观察到大量淡黄色沉淀与少量白色沉淀,说明Ksp(AgCl)>Ksp(AgBr) |
2.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列有关说法正确的是( )
| A. | 若mXa+与nYb-符合题目要求,则m+a=n-b | |
| B. | 若X的原子半径大于Y,则气态氢化物的稳定性HmX一定小于HnY | |
| C. | X,Y一定不是相邻周期元素 | |
| D. | 若X,Y处于同一周期且X离子所带电荷多于Y离子,则离子半径一定为:X>Y |
19.黑火药爆炸时发生如下反应:S+2KNO3+3C→K2S+N2↑+3CO2↑,该反应中作还原剂的物质是( )
| A. | KNO3 | B. | C | C. | KNO3、S | D. | N2、CO2 |
6.用标准盐酸滴定未知浓度的NaOH溶液,下列有关实验操作的说法正确的是( )
| A. | 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 滴定过程中视线应一直注视锥形瓶内混合液颜色的变化 | |
| D. | 用酚酞做指示剂,溶液由无色变浅红色,半分钟不变色为滴定终点 |
16.下列装置或操作能达到目的是( )
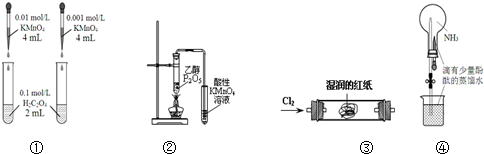

| A. | 装置①依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 装置②证明CH3CH2OH发生消去反应生成了乙烯 | |
| C. | 装置③观察红纸褪色证明氯气具有漂白性 | |
| D. | 打开装置④中的止水夹,挤出胶头滴管中的液体,可观察到红色的喷泉 |
3.能完全中和1.5molNaOH的物质是( )
| A. | 0.75mol硫酸 | B. | 0.75盐酸 | C. | 0.5mol硝酸 | D. | 0.75mol醋酸 |
20.对于粒子${\;}_{6}^{13}$C的说法正确的是( )
| A. | 质量数为13 | B. | 中子数为6 | C. | 质子数为6 | D. | 最外层电子数为6 |
1.下列各组选项中,前者为垃圾类别,后者为处理方法,其中不合理的是( )
| A. | 废旧塑料--回收再利用 | B. | 医疗垃圾--焚烧 | ||
| C. | 厨余垃圾--堆肥 | D. | 废旧电池--填埋 |