题目内容
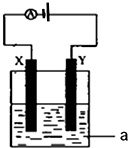
1.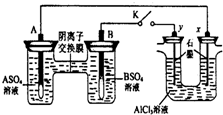 某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )
某同学按如图所示的装置进行实验. A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处SO42一从右向左移动.下列分析正确的是( )| A. | 溶液中(A2+)浓度减小 | |
| B. | B 的电极反应:B-2eˉ═B2+ | |
| C. | y 电极上有 H2 产生,发生还原反应 | |
| D. | 反应初期,x 电极周围出现白色胶状沉淀,不久沉淀溶解 |
分析 该装置中右边装置不能自发的进行氧化还原反应是不能构成原电池只能形成电解池,左边装置中能发生的进行氧化还原反应且符合原电池的构成条件所以是原电池.当 K 闭合时,在交换膜处 SO42-从右向左移动,说明A为负极,B为正极,即A的金属活动性大于B;连接B的y极为Y阳极,连接A的x极为阴极.
解答 解:A、当 K 闭合时,在交换膜处 SO42-从右向左移动,说明A为负极,B为正极,原电池中负极A上金属失电子发生氧化反应,生成金属阳离子进入溶液导致溶液中(A2+)浓度增大,故A错误;
B、当 K 闭合时,在交换膜处 SO42一从右向左移动,说明A为负极,B为正极,B极上溶液中的金属阳离子得电子生成金属单质,电极反应式为B2++2eˉ═B,故B错误;
C、右边装置中连接B的y极为阳极,连接A的x极为阴极,电解池工作时,y极上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,故C错误;
D、右边装置中y极上发生的电极反应式为2Cl--2e-=Cl2↑,x极上发生的电极反应式为2H++2e-=H2↑,由于氢离子放电而氢氧根离子不放电导致溶液呈碱性,铝离子和氢氧根离子反应生成难溶性的氢氧化铝,氢氧化铝和氢氧化钠反应生成可溶性的偏铝酸钠,故D正确.
故选D.
点评 本题考查了原电池和电解池原理,难度较大,明确原电池放电时溶液中阴阳离子的移动方向是解本题的关键.

练习册系列答案
相关题目
11.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol•L-1的Na2CO3溶液中所含钠离子总数为2NA | |
| B. | 标准状况下,22.4L NO与足量O2充分反应,生成的NO2分子数为NA | |
| C. | 常温下,1mol SiC中含有Si-C键的数目为4NA | |
| D. | 常温常压下,33.6L 氯气与足量的铝充分反应,转移电子数为3NA |
16.下列装置或操作能达到目的是( )
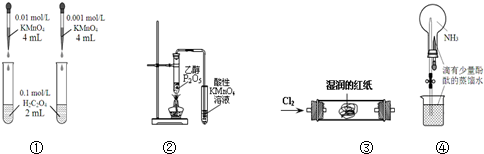

| A. | 装置①依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 装置②证明CH3CH2OH发生消去反应生成了乙烯 | |
| C. | 装置③观察红纸褪色证明氯气具有漂白性 | |
| D. | 打开装置④中的止水夹,挤出胶头滴管中的液体,可观察到红色的喷泉 |
6.“粗盐提纯”实验中,下列操作正确的是( )
| A. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| B. | 蒸发到析出晶体时才需要用玻璃棒搅拌 | |
| C. | 待溶液蒸干后即停止加热 | |
| D. | 当蒸发皿中出现较多晶体时就应停止加热 |
13.在氧化还原反应中,水被还原的是( )
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | Cl2+H2O═HCl+HClO | D. | 3NO2+H2O═2HNO3+NO |
10.下列关于氯气的说法不正确的是( )
| A. | 干燥的液氯能用钢瓶贮存 | B. | 氯气和液氯是两种不同的物质 | ||
| C. | 可以用浓硫酸除去氯气中的水蒸气 | D. | 氯气曾在战争中被用于制造毒气弹 |
11.下列实验操作正确的是( )
| A. | 固体碘与NH4Cl的混合物可以用加热升华的方法分离 | |
| B. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| C. | 可以用米汤检验含碘食盐中的碘元素 | |
| D. | 水银洒落时,可在其表面覆盖一层硫粉进行处理 |
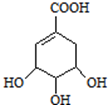 ,如图是以莽草酸A为原料的有机合成路线.
,如图是以莽草酸A为原料的有机合成路线.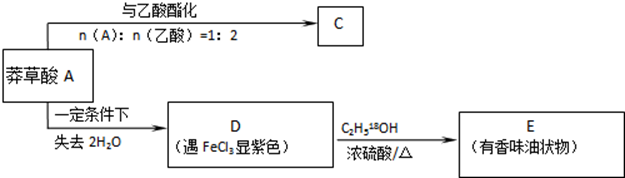
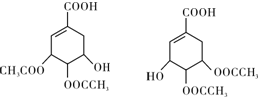
 (任写一种).
(任写一种). .
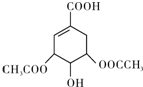
.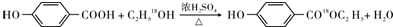 .
. (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.