题目内容
5.如图,有关铁钉腐蚀(除②外,电解质溶液为食盐水)说法不正确的是( )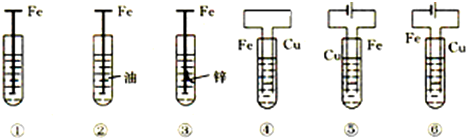
| A. | ③是牺牲阳极的阴极保护法 | |
| B. | 若将⑥的Cu极换成不溶性电极,则⑥是外加电流的阴极保护法 | |
| C. | 腐蚀快到慢的顺序为⑤>④>①>⑥>③>② | |
| D. | ①发生析氢腐蚀 |
分析 金属生锈的条件是:和水以及空气中的氧气接触,再根据原电池正负极腐蚀的快慢比较,作原电池负极金属易被腐蚀,作原电池正极金属易被保护.
解答 解:A、③中Zn活泼作负极,Fe作正极,Fe被保护,属于牺牲阳极的阴极保护法,故A正确;
B、⑥中Fe作阴极被保护,属于外加电流的阴极保护法,故B正确;
C、根据图知⑤⑥为电解池,⑤中Fe作阳极被腐蚀,⑥中Fe作阴极被保护,③④装置是原电池,在④中金属铁做负极被腐蚀,③中金属铁为正极,被保护,①具备金属铁生锈的条件,②不具备金属生锈的条件,所以Fe腐蚀由快到慢的顺序为⑤>④>①>②>③>⑥,故C错误;
D、①的电解质溶液为食盐水,在中性条件下,Fe发生吸氧腐蚀,故D错误;
故选CD.
点评 本题考查了金属的腐蚀与防护,明确原电池原理和电解池原理是解本题关键,注意不同条件下金属腐蚀的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,题目难度不大.

练习册系列答案
相关题目
15.工业合成氨与制备硝酸一般可连续生产,流程如下:
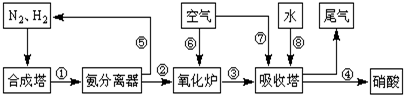
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).若保持温度不变,增加水蒸气的浓度,则K将不变(填“增大”、“减小”、“不变”)
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
(3)在上述流程图中,氧化炉中发生反应的化学方程式为4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.
(4)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$N2+6H2O.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是负极(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).若保持温度不变,增加水蒸气的浓度,则K将不变(填“增大”、“减小”、“不变”)
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$N2+6H2O.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是负极(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
16.下列装置或操作能达到目的是( )
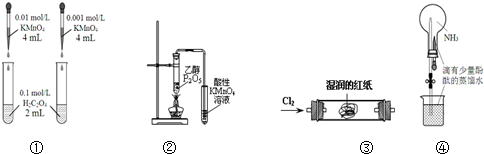

| A. | 装置①依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 装置②证明CH3CH2OH发生消去反应生成了乙烯 | |
| C. | 装置③观察红纸褪色证明氯气具有漂白性 | |
| D. | 打开装置④中的止水夹,挤出胶头滴管中的液体,可观察到红色的喷泉 |
13.在氧化还原反应中,水被还原的是( )
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | Cl2+H2O═HCl+HClO | D. | 3NO2+H2O═2HNO3+NO |
20.对于粒子${\;}_{6}^{13}$C的说法正确的是( )
| A. | 质量数为13 | B. | 中子数为6 | C. | 质子数为6 | D. | 最外层电子数为6 |
10.下列关于氯气的说法不正确的是( )
| A. | 干燥的液氯能用钢瓶贮存 | B. | 氯气和液氯是两种不同的物质 | ||
| C. | 可以用浓硫酸除去氯气中的水蒸气 | D. | 氯气曾在战争中被用于制造毒气弹 |
17.下列推论正确的是( )
| A. | 由“HF比HCl稳定性好”,可推知HF比HCl沸点高 | |
| B. | 由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱 | |
| C. | 由“相同条件下,HF比HCl溶液的酸性弱”,可推知氟的非金属性小于氯的非金属性 | |
| D. | 由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
14.与普通玻璃主要成分不相同的是( )
| A. | 钢化玻璃 | B. | 玻璃纸 | C. | 有机玻璃 | D. | 水玻璃 |
15.用铂电极电解下列电解质溶液(足量)时,当消耗相同电量时,在阳极上有气泡冒出且溶液的pH升高的是( )
| A. | KCl | B. | CuSO4 | C. | AgNO3 | D. | H2SO4 |