题目内容
4.下列各组离子一定能大量共存的是( )| A. | Na+、K+、SO42-、Br- | B. | Fe3+、Mg2+、HCO3-、Cl- | ||
| C. | H+、K+、I-、ClO- | D. | Ag+、NH4+、NO3-、Cl- |
分析 离子之间不反应生成气体、沉淀、弱电解质或发生氧化还原反应、双水解反应、络合反应的就能共存,据此分析解答.
解答 解:A.这几种离子之间不反应,所以能大量共存,故A正确;
B.Fe3+、HCO3-发生双水解反应,所以不能大量共存,故B错误;
C.H+、I-、ClO-发生氧化还原反应而不能大量共存,故C错误;
D.Ag+、Cl-反应生成氯化银沉淀而不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,侧重考查双水解反应、氧化还原反应、复分解反应,明确离子共存条件及离子性质是解本题关键,易错选项是C.

练习册系列答案
相关题目
15.工业合成氨与制备硝酸一般可连续生产,流程如下:

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).若保持温度不变,增加水蒸气的浓度,则K将不变(填“增大”、“减小”、“不变”)
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
(3)在上述流程图中,氧化炉中发生反应的化学方程式为4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.
(4)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$N2+6H2O.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是负极(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).若保持温度不变,增加水蒸气的浓度,则K将不变(填“增大”、“减小”、“不变”)
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$N2+6H2O.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是负极(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
19.黑火药爆炸时发生如下反应:S+2KNO3+3C→K2S+N2↑+3CO2↑,该反应中作还原剂的物质是( )
| A. | KNO3 | B. | C | C. | KNO3、S | D. | N2、CO2 |
16.下列装置或操作能达到目的是( )
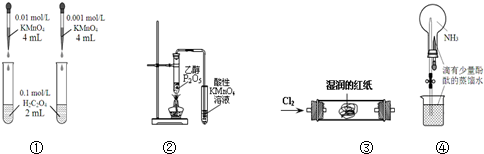

| A. | 装置①依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 装置②证明CH3CH2OH发生消去反应生成了乙烯 | |
| C. | 装置③观察红纸褪色证明氯气具有漂白性 | |
| D. | 打开装置④中的止水夹,挤出胶头滴管中的液体,可观察到红色的喷泉 |
13.在氧化还原反应中,水被还原的是( )
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | Cl2+H2O═HCl+HClO | D. | 3NO2+H2O═2HNO3+NO |
14.与普通玻璃主要成分不相同的是( )
| A. | 钢化玻璃 | B. | 玻璃纸 | C. | 有机玻璃 | D. | 水玻璃 |
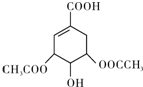
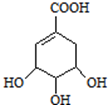 ,如图是以莽草酸A为原料的有机合成路线.
,如图是以莽草酸A为原料的有机合成路线.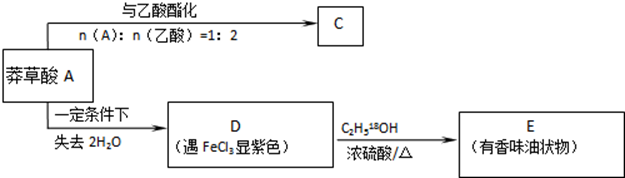
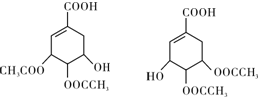
 (任写一种).
(任写一种). .
.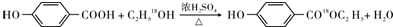 .
.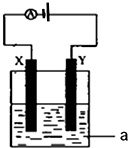 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.