题目内容
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 0.56 L甲烷中含有的共价键数为0.1NA | |
| B. | 标准状况下,1mol SO3含有的氧原子数为3NA | |
| C. | 3mol NO2和足量H2O反应,转移1 NA个电子 | |
| D. | pH=1的稀硫酸中含有的H+数为0.1NA |
分析 A.甲烷状况不确定,气体摩尔体积不确定;
B.1个三氧化硫分子含有3个氧原子;
C.二氧化氮与水反应,二氧化氮既做氧化剂又做还原剂,反应3mol二氧化氮转移2mol电子;
D.溶液体积未知,无法计算.
解答 解;A.甲烷状况不确定,气体摩尔体积不确定,无法计算甲烷的物质的量,故A错误;
B.1个三氧化硫分子含有3个氧原子,1mol SO3含有的氧原子数为3NA,故B正确;
C.二氧化氮与水反应,二氧化氮既做氧化剂又做还原剂,反应3mol二氧化氮转移2mol电子,转移2 NA个电子,故C错误;
D.溶液体积未知,无法计算氢离子个数,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常的应用,主要考查质量换算物质的量计算微粒数,气体摩尔体积的体积应用,题目难度不大.

练习册系列答案
相关题目
16.下列装置或操作能达到目的是( )
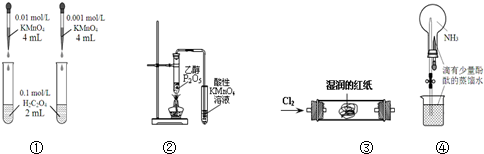

| A. | 装置①依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 装置②证明CH3CH2OH发生消去反应生成了乙烯 | |
| C. | 装置③观察红纸褪色证明氯气具有漂白性 | |
| D. | 打开装置④中的止水夹,挤出胶头滴管中的液体,可观察到红色的喷泉 |
17.下列推论正确的是( )
| A. | 由“HF比HCl稳定性好”,可推知HF比HCl沸点高 | |
| B. | 由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱 | |
| C. | 由“相同条件下,HF比HCl溶液的酸性弱”,可推知氟的非金属性小于氯的非金属性 | |
| D. | 由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
14.与普通玻璃主要成分不相同的是( )
| A. | 钢化玻璃 | B. | 玻璃纸 | C. | 有机玻璃 | D. | 水玻璃 |
1.下列各组选项中,前者为垃圾类别,后者为处理方法,其中不合理的是( )
| A. | 废旧塑料--回收再利用 | B. | 医疗垃圾--焚烧 | ||
| C. | 厨余垃圾--堆肥 | D. | 废旧电池--填埋 |
11.下列实验操作正确的是( )
| A. | 固体碘与NH4Cl的混合物可以用加热升华的方法分离 | |
| B. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| C. | 可以用米汤检验含碘食盐中的碘元素 | |
| D. | 水银洒落时,可在其表面覆盖一层硫粉进行处理 |
15.用铂电极电解下列电解质溶液(足量)时,当消耗相同电量时,在阳极上有气泡冒出且溶液的pH升高的是( )
| A. | KCl | B. | CuSO4 | C. | AgNO3 | D. | H2SO4 |