��Ŀ����
����Ŀ��������N2H4���ֳ��£�����N2O4����������ƽ�����
��1���������������Ǵ�ѧʥ���Ǹ��G�� N��SChrauzer�����õ���ˮ�����ڴ�ý�Ϲ������ºϳɸ�����̬��������ɹ�����д���÷�Ӧ���Ȼ�ѧ����ʽ��_________��
��ѧ�� | ����/KJ��mol-1 |
N-H | 391 |
H-O | 463 |
O=O | 496 |
N��N | 946 |
N-N | 159 |
��2��ˮ��������N2H4��H2O�����к�ǿ�Ļ�ԭ�ԡ���ҵ����ˮ��������ԭ����ȡ�⻯�ƹ��塣������ǽ����ʵ����NaOH��Һ�н��з�Ӧ���ټ���ˮ��������Ҫ�����������з�Ӧ����֪��N2H4��H2O��100�� ���Ϸֽ⡣
�� ���Ʊ�NaI�Ĺ����У����ܻ��е�������_______������������Ҫ�ʵ�����NaOH��Ŀ��___________��
�� Ϊ�˷�ֹˮ���������·ֽ⣬��Ӧ�¶ȿ�����60-70�棬�¶�Ҳ���ܹ��ͣ���ԭ����______��
�� ��ҵ��Ҳ���������ƻ���м��ԭ�������Ʊ��⻯�ƣ���ˮ��������ԭ���ƵõIJ�Ʒ���ȸ��ߣ���ԭ����___________
��3��325K����ʼѹǿΪ100kPaʱ���ں��ݵ��ܱ������г���4.6 g NO2,������Ӧ��
2NO2(g) ![]() N2O4(g)���ﵽƽ��������ڻ�������ƽ����Է�������Ϊ57.5��
N2O4(g)���ﵽƽ��������ڻ�������ƽ����Է�������Ϊ57.5��
�� NO2��N2O4��������������Ũ�ȵĹ�ϵ��ͼ��ʾ��ͼ�н���A��ʾ�÷�Ӧ������״̬Ϊ________��

A��ƽ��״̬ B��������Ӧ�����ƶ� C�����淴Ӧ�����ƶ� D�����ж�
�� ƽ��ʱNO2��ת����Ϊ_______���������µ�Kp=_______��Kp��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
���𰸡� N2(g)+2H2O(g)= N2H4(g)+O2(g����H=��579 kJ��mol-1 NaIO3, ��ʹ��Ӧ�������﷽����� �¶ȹ��ͣ���Ӧ���ʽ��� N2H4��H2O��������IJ���ΪN2��H2O������������ B 40% 0.0056
�����������������(l��������ˮ�����ڴ�ý�Ϲ������ºϳɸ�����̬���������������ݷ�Ӧ����ܼ���-��������ܼ���=�ʱ���д�÷�Ӧ���Ȼ�ѧ����ʽ��
(2��ˮ��������N2H4��H2O�����к�ǿ�Ļ�ԭ�ԡ���ҵ����ˮ��������ԭ����ȡ�⻯�ƹ��塣������ǽ����ʵ����NaOH��Һ�н��з�Ӧ���ټ���ˮ��������Ҫ�����������з�Ӧ����֪��N2H4��H2O��100�� ���Ϸֽ⡣
�� �����������Ʒ�Ӧ���ɵ⻯�ƺ͵����ƣ�����������Ҫ�ʵ�����NaOH�����Դ�ʹ��Ӧ���������
���¶�Խ�ͣ���Ӧ����Խ����
��ˮ��������ԭ���������������ǵ�����
(3) 4.6 g NO2�����ʵ���Ϊ0.1mol�����ݴﵽƽ��������ڻ�������ƽ����Է�������Ϊ57.5���ɼ���ƽ������������������ʵ���![]() �����á�����ʽ�������ƽ��ʱNO2�� N2O4���ʵ�����
�����á�����ʽ�������ƽ��ʱNO2�� N2O4���ʵ�����
������(l��������ˮ�����ڴ�ý�Ϲ������ºϳɸ�����̬��������������ѧ����ʽΪN2+2H2O= N2H4+O2�����ݷ�Ӧ����ܼ���-��������ܼ���=�ʱ�����H = 946+463��4 - 391��4 �C 159 -496 = ��579 kJ��mol-1 �����Ը÷�Ӧ���Ȼ�ѧ����ʽΪN2(g)+2H2O(g)= N2H4(g)+O2(g����H=��579 kJ��mol-1��
(2���� �����������Ʒ�Ӧ���ɵ⻯�ƺ͵��������������Ʊ�NaI�Ĺ����������ܻ��е�������NaIO3������������Ҫ�ʵ�����NaOH�����Դ�ʹ��Ӧ������У�
���¶�Խ�ͣ���Ӧ����Խ���������¶Ȳ��ܹ�����
��ˮ��������ԭ���������������ǵ�����������������
(3) ��ͼ�н���A��ʾ����������v��N2O4��=v��NO2�������ﵽƽ��ʱNO2����������Ӧ����N2O4�������ʵ�2����v��NO2��=2v��N2O4������˴�ʱv����v�������Է�Ӧ������Ӧ�����ƶ�����ѡB��
4.6 g NO2�����ʵ���Ϊ0.1mol�����ݴﵽƽ��������ڻ�������ƽ����Է�������Ϊ57.5���ɼ���ƽ������������������ʵ���![]() ��
��
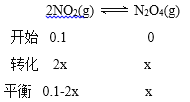
0.1-2x+ x=0.08 ��x=0.02mol
�� ƽ��ʱNO2��ת����Ϊ![]() ����ʼ���ʵ���Ϊ0.1mol��ѹǿΪ100kPa��ƽ��ʱ���ʵ���Ϊ0.08mol��ѹǿΪ80kPa��, Kp=
����ʼ���ʵ���Ϊ0.1mol��ѹǿΪ100kPa��ƽ��ʱ���ʵ���Ϊ0.08mol��ѹǿΪ80kPa��, Kp=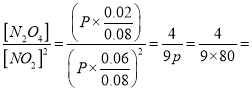 0.0056��
0.0056��