题目内容
【题目】盐酸、硝酸、硫酸在工业生产中具有重要的作用。
(1)“王水”是浓盐酸和浓峭酸按体积比3: l组成的混合物,“王水”溶金的原理为HNO3+3HCl=Cl2+NOCl+2H2O,金离子与氯离子形成AuCl4-离子,增强了金属的还原能力。
① 试写出金与王水反应生成H[AuCl4]的化学方程式:_________;其中AuCl4-的配位数是________;
② 已知:NOCl的熔点-645℃,沸点-5.5℃,NOCl固体的晶体类型是__________;
③ 组成NOCl分子的三种元素中,电负性N_____O(填“>”、“<”或“=”);熔沸点H2O____NH3(填“>”、“<”或“=”);与NH3互为等电子体的阳离子有________(写出一种即可)。
(2)硝酸在有机反应中也有重要用途。TNT炸药、苦味酸是硝酸与甲苯、苯酚发生取代反应制成的。其中甲苯分子中碳原子的杂化方式为______, 1mol甲苯分子中含有σ键的数目为_____;试解释在水中苯酚溶解度大于甲苯的原因________。
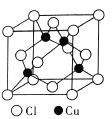
(3)在硝酸工业中有一种重要金属即为Cu,CuCl晶胞结构如图所示。已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶胞边长为_______pm (只写计算式)。
【答案】 Au + HNO3+ 4HCl= H[AuCl4]+NO+2H2O 4 分子晶体 < > H3O+ sp2、sp3 15NA 苯酚和水分子中都有羟基且苯酚与水分子之间可形成氢键 ![]()
【解析】试题分析:(l)①硝酸具有强氧化性,金与王水反应生成H[AuCl4]和NO、H2O;配合物或晶体中一个微粒周围最近邻的微粒数称为配位数;
②根据熔沸点低分析NOCl晶体类型;
③ 组成NOCl分子的三种元素中,同周期从左到右电负性增大;NH3中氢键强度小数量少(1);水中氢键强度大,可以形成的氢键数量多(2);等电子体是原子数相同、价电子数也相同的分子或离子。
(2)甲苯分子中,甲基上碳原子是单键碳、苯环上碳原子为平面结构;任意2个成键原子之间都有1个σ键;苯酚和水分子中都有羟基且苯酚与水分子之间可形成氢键。
(3)根据均摊原则计算CuCl晶胞中含有Cu、Cl原子数,根据![]() 计算晶胞边长。
计算晶胞边长。
解析:(l)①硝酸具有强氧化性,金与王水反应生成H[AuCl4]和NO、H2O,反应方程式为Au + HNO3+ 4HCl= H[AuCl4]+NO+2H2O;配合物或晶体中一个微粒周围最近邻的微粒数称为配位数,AuCl4-中Au原子周围有4个Cl原子,配位数是4;
②NOCl熔沸点低,所以 NOCl 属于分子晶体;
③同周期从左到右电负性增大,电负性N<O;NH3中氢键强度小数量少(1),水中氢键强度大,可以形成的氢键数量多(2),熔沸点H2O>NH3;等电子体是原子数相同、价电子数也相同的分子或离子,与NH3互为等电子体的阳离子有H3O+。
(2)甲苯分子中,甲基上碳原子是单键碳、苯环上碳原子为平面结构,所以甲苯分子中碳原子的杂化方式为sp2、sp3;任意2个成键原子之间都有1个σ键,所以1个甲苯分子中含有15个σ键,1mol甲苯分子中含有σ键的数目为15 NA;苯酚和水分子中都有羟基且苯酚与水分子之间可形成 氢键,所以在水中苯酚溶解度大于甲苯。
(3)根据均摊原则CuCl晶胞中含有Cu原子数4个、Cl原子数![]() ,设晶胞边长为a pm, 1mol晶胞的质量为99.5×4g,体积为
,设晶胞边长为a pm, 1mol晶胞的质量为99.5×4g,体积为![]() ,根据
,根据![]() ,
, ![]() ,a=
,a=![]() 。
。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】联氮(N2H4)又称肼,它与N2O4常用作火箭推进剂。
(1)美国加利福尼亚大学圣地亚哥的G· N·SChrauzer等人用氮和水蒸气在触媒上光照射下合成高能气态联氮初获成功。试写出该反应的热化学方程式:_________。
化学健 | 键能/KJ·mol-1 |
N-H | 391 |
H-O | 463 |
O=O | 496 |
N≡N | 946 |
N-N | 159 |
(2)水合联氮(N2H4·H2O)具有很强的还原性。工业上用水合联氨还原法制取碘化钠固体。其操作是将单质碘加人NaOH溶液中进行反应后再加入水合联氮(要稍微过量)进行反应。已知:N2H4·H2O在100℃ 以上分解。
① 在制备NaI的过程中,可能混有的物质是_______,生产过程中要适当补充NaOH,目是___________;
② 为了防止水合联氨高温分解,反应温度控制在60-70℃,温度也不能过低.其原因是______;
③ 工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合联氨还原法制得的产品纯度更高,其原因是___________
(3)325K、起始压强为100kPa时,在恒容的密闭容器中充入4.6 g NO2,发生反应:
2NO2(g) ![]() N2O4(g),达到平衡后容器内混合气体的平均相对分子质量为57.5。
N2O4(g),达到平衡后容器内混合气体的平均相对分子质量为57.5。
① NO2与N2O4的消耗速率与其浓度的关系如图所示,图中交点A表示该反应所处的状态为________;
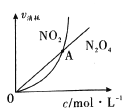
A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
② 平衡时NO2的转化率为_______,此条件下的Kp=_______(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【题目】为探究外界条件对可逆反应A(g)+B(g)![]() C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1molB,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为II、III、IV。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1molB,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为II、III、IV。
A | B | C | |
I | 0.050mol·L-1 | 0.050mol·L-1 | 0.050mol·L-1 |
II | 0.070mol·L-1 | 0.070mol·L-1 | 0.098mol·L-1 |
III | 0.060mol·L-1 | 0.060mol·L-1 | 0.040mol·L-1 |
IV | 0.080mol·L-1 | 0.080mol·L-1 | 0.12mol·L-1 |
针对上述系列实验,下列结论中错误的是
A. 由I中数据可计算出该温度下反应的平衡常数K=20
B. II可能是通过增大C的浓度实现的
C. 若III只是升高温度,则与I比较,可以判断出正反应一定是放热反应
D. 第IV组实验数据的得出,通过压缩容器的体积就可以实现