题目内容
【题目】A—F是几种典型有机代表物的分子模型,请看图回答下列问题。
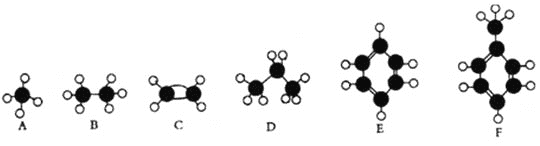
(1)常温下含碳量最高的气态烃是________(填对应字母);
(2)能够发生加成反应的烃有 ___________(填数字)种;
(3)一卤代物种类最多的是 ___________(填对应字母);
(4)写出实验室制取C的化学方程式 _____________________________________________________;
(5)写出E发生溴代反应的化学方程式__________________________________________________;
(6)按系统命名法填写下列有机物的名称: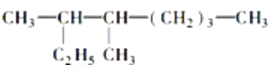 的名称是:___________________________________________________________________。
的名称是:___________________________________________________________________。
2,6-二甲基-4-乙基-2-辛烯的结构简式是: _____________________________________________,
1mol该烃完全燃烧需消耗氧气 _______________ mol.
【答案】 C 3 F (4)CH3CH2OH![]() CH2= CH2↑+ H2OCH2= CH2↑+ H2O;
CH2= CH2↑+ H2OCH2= CH2↑+ H2O; ![]() 3,4-二甲基辛烷
3,4-二甲基辛烷 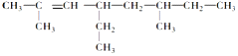 18
18
【解析】根据分子球棍模型可知A为甲烷,B为乙烷,C为乙烯,D为丙烷,E为苯,F为甲苯。
(1)常温下气态烃为甲烷、乙烷、乙烯、丙烷,其中含碳量最高的是乙烯,所以C正确,故答案为:C;
(2)能够发生加成的烃为:乙烯、苯和甲苯,共3种, 故答案为:3;
(3)一卤代物种类最多的是甲苯,共有4种一氯代物,即F正确,故答案为:F;
(4)实验室用乙醇发生消去反应制备乙烯,反应的化学方程式为CH3CH2OH![]() CH2 = CH2↑+ H2O,故答案为:CH3CH2OH
CH2 = CH2↑+ H2O,故答案为:CH3CH2OH![]() CH2 = CH2↑+ H2O;
CH2 = CH2↑+ H2O;
(5)苯在催化剂存在是与溴发生取代反应,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(6)根据烷烃的命名方法,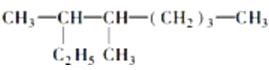 分子中最长的碳链含有8个碳原子,为辛烷,主链含有2个甲基,因此名称为3,4-二甲基辛烷;2,6-二甲基-4-乙基-2-辛烯的结构简式为
分子中最长的碳链含有8个碳原子,为辛烷,主链含有2个甲基,因此名称为3,4-二甲基辛烷;2,6-二甲基-4-乙基-2-辛烯的结构简式为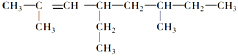 ,该物质的分子式为C12H24,1mol该烃完全燃烧需消耗氧气的物质的量为12+
,该物质的分子式为C12H24,1mol该烃完全燃烧需消耗氧气的物质的量为12+![]() =18 mol,故答案为:3,4-二甲基辛烷 ;
=18 mol,故答案为:3,4-二甲基辛烷 ;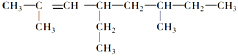 ;18。
;18。

【题目】联氮(N2H4)又称肼,它与N2O4常用作火箭推进剂。
(1)美国加利福尼亚大学圣地亚哥的G· N·SChrauzer等人用氮和水蒸气在触媒上光照射下合成高能气态联氮初获成功。试写出该反应的热化学方程式:_________。
化学健 | 键能/KJ·mol-1 |
N-H | 391 |
H-O | 463 |
O=O | 496 |
N≡N | 946 |
N-N | 159 |
(2)水合联氮(N2H4·H2O)具有很强的还原性。工业上用水合联氨还原法制取碘化钠固体。其操作是将单质碘加人NaOH溶液中进行反应后再加入水合联氮(要稍微过量)进行反应。已知:N2H4·H2O在100℃ 以上分解。
① 在制备NaI的过程中,可能混有的物质是_______,生产过程中要适当补充NaOH,目是___________;
② 为了防止水合联氨高温分解,反应温度控制在60-70℃,温度也不能过低.其原因是______;
③ 工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合联氨还原法制得的产品纯度更高,其原因是___________
(3)325K、起始压强为100kPa时,在恒容的密闭容器中充入4.6 g NO2,发生反应:
2NO2(g) ![]() N2O4(g),达到平衡后容器内混合气体的平均相对分子质量为57.5。
N2O4(g),达到平衡后容器内混合气体的平均相对分子质量为57.5。
① NO2与N2O4的消耗速率与其浓度的关系如图所示,图中交点A表示该反应所处的状态为________;

A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
② 平衡时NO2的转化率为_______,此条件下的Kp=_______(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【题目】表1是元素周期表的一部分:
氧 | X |
Y | Z |
表1
数据编号 | 滴入NaOH溶液的体积/mL | 溶液的pH | |
HX | HZ | ||
① | 0 | 3 | 1 |
② | 20.00 | a | 7 |
表2
25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20.00 mL浓度均为0.1000mol/ L的两种酸HX、HZ(忽略溶液体积变化),实验数据如表2,下列判断正确的是
A. 表格中a<7
B. 25℃时,HX的电离常数Ka=1×10-6
C. Y和Z两元素的简单氢化物受热分解,前者分解温度高
D. 0.1000mol/L Na2Y的水溶液中:c(Y2-)+c(HY-)+c(H2Y)=0.1000mol/L
【题目】为探究外界条件对可逆反应A(g)+B(g)![]() C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1molB,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为II、III、IV。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1molB,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为II、III、IV。
A | B | C | |
I | 0.050mol·L-1 | 0.050mol·L-1 | 0.050mol·L-1 |
II | 0.070mol·L-1 | 0.070mol·L-1 | 0.098mol·L-1 |
III | 0.060mol·L-1 | 0.060mol·L-1 | 0.040mol·L-1 |
IV | 0.080mol·L-1 | 0.080mol·L-1 | 0.12mol·L-1 |
针对上述系列实验,下列结论中错误的是
A. 由I中数据可计算出该温度下反应的平衡常数K=20
B. II可能是通过增大C的浓度实现的
C. 若III只是升高温度,则与I比较,可以判断出正反应一定是放热反应
D. 第IV组实验数据的得出,通过压缩容器的体积就可以实现
