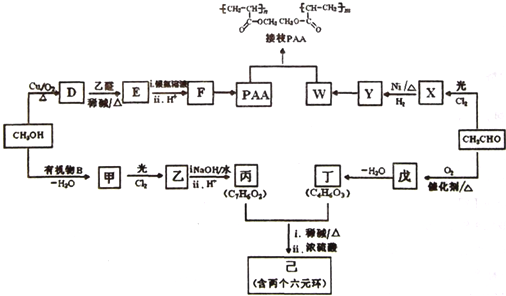
题目内容
17.下表为三种元素的性质或结构信息:下列推断正确的是( )| 元素编号 | 元素性质或结构 |
| X | 3p亚层上有1个空轨道 |
| Y | 第三周期元素形成的简单离子中半径最大 |
| Z | 短周期中原子最容易失电子 |
| A. | 氢化物的稳定性:X<Y | B. | 单质与水反应的难易程度:Y>Z | ||
| C. | 单质的熔点:X<Y<Z | D. | X、Y、Z的氧化物晶体类型相同 |
分析 X原子3p亚层上有1个空轨道,核外电子排布为1s22s22p63s23p2,则X为Si;Y是第三周期元素形成的简单离子中半径最大的,则Y为S元素;短周期中Z原子最容易失电子,则Z为Na,据此解答.
解答 解:X原子3p亚层上有1个空轨道,核外电子排布为1s22s22p63s23p2,则X为Si;Y是第三周期元素形成的简单离子中半径最大的,则Y为S元素;短周期中Z原子最容易失电子,则Z为Na.
A.非金属性X(Si)<Y(S),故氢化物稳定性:X<Y,故A正确;
B.钠与水剧烈反应,但硫单质不与水反应,故B错误;
C.硫单质为分子晶体,Si单质为原子晶体,硅的熔点原高于硫的,故C错误;
D.X、Y、Z的氧化物分别为二氧化硅、二氧化硫(或三氧化硫)、氧化钠(或过氧化钠),分别属于原子晶体、分子晶体、离子晶体,故D错误,
故选A.
点评 本题考查原子结构与元素性质,比较基础,推断元素是解题关键,注意对基础知识的理解掌握.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
8.下列说法正确的是( )
| A. | 分子式为C10H1202的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种 | |
| B. | 分子式为C4H8Cl2机物,只含有一个甲基的同分异构体有7种 | |
| C. | 分子式为C4H10O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
5.相同质量的铜片分别与体积相同且过量的浓硝酸、稀硝酸反应,二者比较相等的是( )
| A. | 铜片消耗完所需时间 | |
| B. | 反应中氧化剂得到电子总数 | |
| C. | 反应后溶液中铜离子浓度(反应后溶液体积不变) | |
| D. | 反应生成气体的体积(同温、同压) |
12.下列化工生产过程中的主要反应,不涉及氧化还原反应的是( )
| A. | 制纯碱 | B. | 制烧碱 | C. | 制漂白粉 | D. | 制硝酸 |
2.100mL 5mol/L的氨水吸收一定量的SO2气体后,二氧化硫与氨水完全反应生成盐.向所得溶液中加入0.7mol Na2O2固体,充分反应后加热使气体全部逸出,收集到的干燥气体的平均相对分子质量可能为( )
| A. | 20 | B. | 21 | C. | 22 | D. | 23 |
9.H、C、N、Cl、Na、Al是常见的六种元素
(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
(3)用电子式表示Na Cl的形成过程: .
.
(4)已知在常温常压下:
写出H2与Cl2反应的热化学方程式:H2(g)+Cl2(g)═2HCl(g)△H=(a+c-2b)kJ•mol-1;.
(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
| 稳定性 | 得电子能力 | 离子半径 | 电负性 |
| CH4<NH3 | 1H=2H | Na+>Al3+ | C>Al |
 .
.(4)已知在常温常压下:
| 化学键 | H-H | H-Cl | Cl-Cl |
| 键能kJ/mol | a | b | c |
7.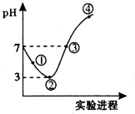 常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
 常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通人100mL水中至饱和,然后向所得饱和氯水中逐滴加人0.1mol/LNaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 曲线③④段有离子反应:HClO+OH-=ClO-+H2O | |
| B. | 可依据②处数据计算所溶解的n(Cl2) | |
| C. | ③处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ①处c(H+)约为②处c(H+)的两倍 |
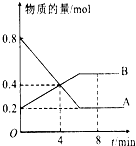 某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据
某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据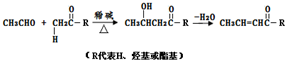
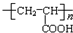 +HOCH2CH2OH$→_{△}^{浓硫酸}$
+HOCH2CH2OH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. +NaOH→
+NaOH→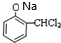 +H2O.
+H2O.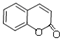 .
.