题目内容
8.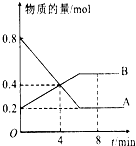 某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据
某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)该反应的化学方程式为2A?B.
(2)反应开始至4min时,A的平均反应速率为0.05mol/(L•min),此时B的浓度为0.2mol/L.
(3)4min时,反应是否达平衡状态?否(填“是”或“否”),8min时,V正=V逆(填“>”“<”或“=”).
(4)平衡时反应物的转化率为75%.
分析 (1)依据图象分析A为反应物,B为生成物,物质的量不变化说明反应达到平衡状态,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比写出化学方程式;
(2)依据反应速率V=$\frac{△c}{△t}$计算;根据C=$\frac{n}{V}$进行计算;
(3)图象分析随时间变化AB物质的量发生变化,说明未达到平衡8分钟时AB物质的量不变,说明反应达到平衡状态;
(4)平衡时反应物的转化率为:$\frac{反应物的变化量}{起始量}×100%$.
解答 解:(1)图象分析A为反应物,B为生成物,物质的量不变化说明反应达到平衡状态,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比,A物质的量变化=0.8mol-0.2mol=0.6mol;B变化物质的量=0.5mol-0.2mol=0.3mol,AB反应的物质的量之比2:1,所以反应的化学方程式:2A?B,故答案为:2A?B;
(2)反应开始至4min时,A物质的量变化=0.8mol-0.4mol=0.4mol,A的平均反应速率=$\frac{\frac{0.4mol}{2L}}{4min}$=0.05mol/L•min,C=$\frac{n}{V}$=$\frac{0.4mol}{2L}$=0.2mol/L,故答案为:0.05mol/L•min;0.2mol/L;
(3)图象分析随时间变化AB物质的量发生变化,说明未达到平衡,8分钟时AB物质的量不变,说明反应达到平衡状态,故答案为:否;=;
(4)平衡时反应物的转化率为:$\frac{反应物的变化量}{起始量}×100%$=$\frac{0.8-0.2}{0.8}×100%$=75%,故答案为:75%.
点评 本题考查了化学平衡影响因素分析,化学反应速率计算应用,主要是图象分析判断,题目难度中等.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案| A. | Al、Si、P | B. | I、Br、Cl | C. | Na、Mg、Al | D. | O、S、Na |
| A. | FeCl3 | B. | 浓硫酸 | C. | NaCl | D. | NaNO3 |
| A. | SO2,H2S,O2 | B. | CH4,H2,CO | C. | NH3,H2,N2 | D. | HCl,Cl2,CO2 |
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能肯定 |
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32-②
向0.1mol/L 的NaHSO3 溶液中分别加入以下物质,下列有关说法正确的是( )
| A. | 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | |
| B. | NaHSO3 溶液中,c(H2SO3)>c(SO32-),加水稀释后离子浓度均减小 | |
| C. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$减小,$\frac{c(O{H}^{-})}{c({H}^{+})}$的值增大 | |
| D. | 加入氨水至中性,则c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
| 元素编号 | 元素性质或结构 |
| X | 3p亚层上有1个空轨道 |
| Y | 第三周期元素形成的简单离子中半径最大 |
| Z | 短周期中原子最容易失电子 |
| A. | 氢化物的稳定性:X<Y | B. | 单质与水反应的难易程度:Y>Z | ||
| C. | 单质的熔点:X<Y<Z | D. | X、Y、Z的氧化物晶体类型相同 |
 ,B为18电子分子,其结构式为
,B为18电子分子,其结构式为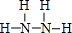 .
.