题目内容
12.下列化工生产过程中的主要反应,不涉及氧化还原反应的是( )| A. | 制纯碱 | B. | 制烧碱 | C. | 制漂白粉 | D. | 制硝酸 |
分析 有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化.
解答 解:A.氨碱法生产纯碱涉及的方程式为:NH3+CO2+H2O+NaCl═NaHCO3+NH4Cl、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,这几个方程式中都没有电子的转移,所以不涉及氧化还原反应,故A选;
B.涉及的反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,该反应中有电子的转移,属于氧化还原反应,故B不选;
C.制漂白粉用氯气与氢氧化钙反应,Cl元素的化合价发生变化,为氧化还原反应,故C不选;
D.涉及的反应有4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,这几个反应都有电子的转移,所以涉及氧化还原反应,故D不选;
故选A.
点评 本题考查氧化还原反应、化学工业原理,明确各工业生成原理是解本题关键,难度不大.

练习册系列答案
相关题目
3.下列各组气体中,通常情况下能共存,并都能用浓硫酸和碱石灰干燥的是( )
| A. | SO2,H2S,O2 | B. | CH4,H2,CO | C. | NH3,H2,N2 | D. | HCl,Cl2,CO2 |
3.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,错误的是( )
| A. | 氢化物的稳定性Y<Z<W | |
| B. | Y的单质常用来制造光导纤维 | |
| C. | W的单质可作为水处理中的消毒剂 | |
| D. | X的最高价氧化物对应的水化物可与W的单质发生反应 |
20.以焦炭为主要原料合成NH3,为了使通入合成塔的N2与H2保持1:3的体积比,则焦炭(不计燃烧中的消耗)与空气的物质的量之比约为( )(N2约占空气总体积的$\frac{4}{5}$)
| A. | 1:3 | B. | 3:2 | C. | 6:5 | D. | 4:3 |
7.紫苏醇的结构简式如图所示.下列有关紫苏醇的说法正确的是( )


| A. | 与乙醇互为同系物 | |
| B. | 一定条件下能与乙酸发生酯化反应 | |
| C. | 存在属于芳香族化合物的同分异构体 | |
| D. | 能与溴水、酸性高锰酸钾溶液发生加成反应 |
17.下表为三种元素的性质或结构信息:下列推断正确的是( )
| 元素编号 | 元素性质或结构 |
| X | 3p亚层上有1个空轨道 |
| Y | 第三周期元素形成的简单离子中半径最大 |
| Z | 短周期中原子最容易失电子 |
| A. | 氢化物的稳定性:X<Y | B. | 单质与水反应的难易程度:Y>Z | ||
| C. | 单质的熔点:X<Y<Z | D. | X、Y、Z的氧化物晶体类型相同 |
4.下表中对应关系正确的是( )
| A.由淀粉得到的酒精,Na2S溶液中存在的HS- | 均为水解反应生成 |
| B.C+CO2=2CO,3C+SiO2=SiC+2CO | 均为碳单质只作还原剂的氧化还原反应. |
| C.由Fe生成FeCl2或FeCl3,由Na生成Na2O或Na2O2 | 均可通过化合反应实现 |
| D.乙醇使酸性KMnO4溶液褪色,SO2使滴有酚酞的NaOH溶液褪色 | 均发生氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
1.下列有关化学用语表示正确的是( )
| A. | Al3+的结构示意图: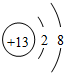 | B. | NaClO的电子式: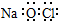 | ||
| C. | 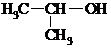 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | D. | 乙醛分子的比例模型: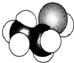 |
2.下列实验操作、现象和结论不正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 用玻璃杯蘸取X溶液沾到淀粉KI试纸上 | 试纸变蓝色 | X溶液可能是氯水 |
| B | 向稀HNO3和稀H2SO4中分别加入Fe粉 | 均有气泡冒出 | 两者均发生氧化还原反应 |
| C | 向酚酞溶液中加入过量的Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的 碱有漂白性 |
| D | 将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰 | 黑色的铜丝变红 | CuO被内焰中的乙醇蒸气还原 |
| A. | A | B. | B | C. | C | D. | D |