题目内容
【题目】用下图所示实验装置进行实验研究(图中a、b、c表示止水夹),请对其方案进行完善或评价。
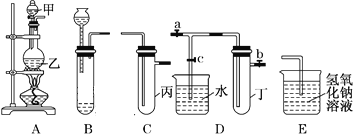
(1)实验室用装置A来制取Cl2,反应的离子方程式是______________;若将装置B、C、E相连后,用浓盐酸和______(填下列试剂的标号)为原料可制取Cl2。
a.KMnO4固体 b.KClO3固体 c.KCl固体 d.浓硫酸
(2)用装置B来制取制取氯气,并将装置B、C、E相连,在丙中加入适量水,即可制得氯水。向该氯水中加入大理石,充分振荡,观察到氯水的黄绿色逐渐褪去,同时产生少量气泡。某同学根据此现象推断出氯水呈酸性,请问该同学的推断是否合理?______________(填“合理”或“不合理”),若不合理,请说明理由(若合理,此空无需填写):_________________。
(3)为了探究氯水与大理石的反应,用装置A来制取氯气,并依次连接装置A、C、C、E。在第一个装置C的丙中,应加入的试剂是____________;在第二个装置C的丙中,加入适量水,即制得氯水。向制得的氯水中加入过量的大理石,反应结束后将所得溶液分成四等分,进行I、Ⅱ、Ⅲ、Ⅳ四个实验,实验操作如下,将实验现象或者实验结论填入下表:
实验序号 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 将该溶液滴在有色布条上 | 有色布条迅速褪色 | ①该溶液中含有__________ |
Ⅱ | 向该溶液中滴加碳酸钠溶液 | ②___________ | 该溶液中含有Ca2+ |
Ⅲ | 向该溶液中滴加稀盐酸 | 有无色气泡产生 | ③无色气体是____________ |
Ⅳ | 加热该溶液 | 溶液变浑浊并产生大量气体 | ④该溶液中含有__________ |
⑤通过上述实验,得出氯水和过量的大理石反应的化学方程式为________________。
【答案】4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2Oab不合理制取的氯气中含有HCl气体,HCl溶于水后能与碳酸钙反应产生气泡饱和食盐水HClO产生白色沉淀CO2Ca(HCO3)22CaCO3+2Cl2+2H2O=CaCl2+Ca(HCO3)2+2HClO
Mn2++Cl2↑+2H2Oab不合理制取的氯气中含有HCl气体,HCl溶于水后能与碳酸钙反应产生气泡饱和食盐水HClO产生白色沉淀CO2Ca(HCO3)22CaCO3+2Cl2+2H2O=CaCl2+Ca(HCO3)2+2HClO
【解析】(1)实验室用浓盐酸和MnO2混合加热制取Cl2,反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,相应反应的离子方程式是4H++2Cl-+MnO2
MnCl2+Cl2↑+2H2O,相应反应的离子方程式是4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O ;a.KMnO4固体和浓盐酸混合有氯气生成且反应不需要加热,故a正确;b.KClO3固体和浓盐酸混合有氯气生成且反应不需要加热,故b正确; c.KCl固体和浓盐酸混合无氯气生成,故c错误; d.浓硫酸和浓盐酸混合无氯气生成,故d错误;答案为ab;
Mn2++Cl2↑+2H2O ;a.KMnO4固体和浓盐酸混合有氯气生成且反应不需要加热,故a正确;b.KClO3固体和浓盐酸混合有氯气生成且反应不需要加热,故b正确; c.KCl固体和浓盐酸混合无氯气生成,故c错误; d.浓硫酸和浓盐酸混合无氯气生成,故d错误;答案为ab;
(2)浓盐酸有挥发性,制取的氯气中含有HCl气体,HCl溶于水后能与碳酸钙反应产生气泡,故无法判断氯水呈酸性,该同学的推断不合理;
(3)利用二氧化锰和浓盐酸混合加热制氯气,所得氯气中混有挥发出的HCl气体,需要先通过装置C的丙中饱和食盐水除去HCl;I、所得溶液使有色布条褪色,可知溶液中含有HClO;Ⅱ、所得溶液中滴加碳酸钠溶液有白色沉淀,说明溶液中含有Ca2+;Ⅲ、向该溶液中滴加稀盐酸有无色气泡产生,此气体为二氧化碳;Ⅳ、加热该溶液变浑浊前有气体产生,说明溶液中可溶性的碳酸氢钙;
⑤结合上述实验结论,可知氯水和过量的大理石反应后的溶液中有HClO、Ca(HCO3)2和CaCl2,发生反应的化学方程式为2CaCO3+2Cl2+2H2O=CaCl2+Ca(HCO3)2+2HClO。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案