题目内容
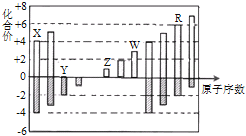
【题目】已知A、B、C、D为四种短周期元素,其中A、B、D为相邻的同周期元素, B、C同主族,且B、C可形成共价化合物BC3 和BC2 ,A的原子结构示意图如右图所示。据此填空:

(1)A的元素名称为________,其气态氢化物的化学式为____________。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为____________________(填元素符号)。
(3)B和D最高价氧化物的水化物化学式分别为____________和____________。
(4)上述四种元素形成的氢化物中沸点最高的是_______(填化学式),原因是________________。
【答案】 硅 SiH4 O S P Si H2SO4 H3PO4 H2O 水分子间能形成氢键。
【解析】本题考查核外电子排布规律、熔沸点高低判断、半径大小比较,(1)根据核外电子排布规律,K层最多容纳2个电子,即x=2,y=14,则A为Si,名称为硅,其气态氢化物是SiH4;(2)B和C同主族,且形成共价化合物BC3和BC2,即B为S,C为O,A、B、D为相邻的同周期元素,即D为P,电子层越多半径越大,电子层相同,半径随着原子序数的递增而减小,即原子半径大小顺序是:O<S<P<Si;(3)根据(1)和(2)的分析,形成最高价氧化物的水化物是H2SO4、H3PO4;(4)形成的氢化物分别是SiH4、H2S、H2O、PH3,常温下H2O是液体,且H2O分子间形成分子间氢键,含有分子间氢键的物质熔沸点高。

 阅读快车系列答案
阅读快车系列答案【题目】用下图所示实验装置进行实验研究(图中a、b、c表示止水夹),请对其方案进行完善或评价。
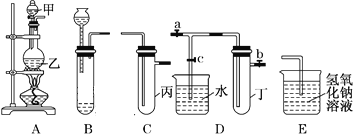
(1)实验室用装置A来制取Cl2,反应的离子方程式是______________;若将装置B、C、E相连后,用浓盐酸和______(填下列试剂的标号)为原料可制取Cl2。
a.KMnO4固体 b.KClO3固体 c.KCl固体 d.浓硫酸
(2)用装置B来制取制取氯气,并将装置B、C、E相连,在丙中加入适量水,即可制得氯水。向该氯水中加入大理石,充分振荡,观察到氯水的黄绿色逐渐褪去,同时产生少量气泡。某同学根据此现象推断出氯水呈酸性,请问该同学的推断是否合理?______________(填“合理”或“不合理”),若不合理,请说明理由(若合理,此空无需填写):_________________。
(3)为了探究氯水与大理石的反应,用装置A来制取氯气,并依次连接装置A、C、C、E。在第一个装置C的丙中,应加入的试剂是____________;在第二个装置C的丙中,加入适量水,即制得氯水。向制得的氯水中加入过量的大理石,反应结束后将所得溶液分成四等分,进行I、Ⅱ、Ⅲ、Ⅳ四个实验,实验操作如下,将实验现象或者实验结论填入下表:
实验序号 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 将该溶液滴在有色布条上 | 有色布条迅速褪色 | ①该溶液中含有__________ |
Ⅱ | 向该溶液中滴加碳酸钠溶液 | ②___________ | 该溶液中含有Ca2+ |
Ⅲ | 向该溶液中滴加稀盐酸 | 有无色气泡产生 | ③无色气体是____________ |
Ⅳ | 加热该溶液 | 溶液变浑浊并产生大量气体 | ④该溶液中含有__________ |
⑤通过上述实验,得出氯水和过量的大理石反应的化学方程式为________________。