题目内容
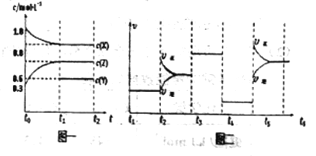
【题目】对于反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下,下列说法正确的是
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下,下列说法正确的是
A.改变压强,平衡不发生移动,反应放出的热量不变
B.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
C.若在原电池中进行,反应放出的热量不变
D.升高温度,反应速率加快,反应放出的热量不变
【答案】A
【解析】
试题分析:A.反应前后体积不变,则改变压强,平衡不发生移动,反应放出的热量不变,A正确; B.加入催化剂,改变了反应的途径,但反应热不变,B错误;C.若在原电池中进行,化学能转化成电能,反应放出的热量明显减少,C错误;D.正反应是放热反应,升高温度,反应速率加快,逆向移动,反应放出的热量减少,D错误;答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】用下图所示实验装置进行实验研究(图中a、b、c表示止水夹),请对其方案进行完善或评价。
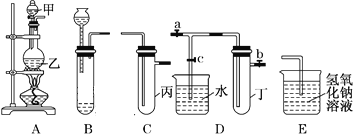
(1)实验室用装置A来制取Cl2,反应的离子方程式是______________;若将装置B、C、E相连后,用浓盐酸和______(填下列试剂的标号)为原料可制取Cl2。
a.KMnO4固体 b.KClO3固体 c.KCl固体 d.浓硫酸
(2)用装置B来制取制取氯气,并将装置B、C、E相连,在丙中加入适量水,即可制得氯水。向该氯水中加入大理石,充分振荡,观察到氯水的黄绿色逐渐褪去,同时产生少量气泡。某同学根据此现象推断出氯水呈酸性,请问该同学的推断是否合理?______________(填“合理”或“不合理”),若不合理,请说明理由(若合理,此空无需填写):_________________。
(3)为了探究氯水与大理石的反应,用装置A来制取氯气,并依次连接装置A、C、C、E。在第一个装置C的丙中,应加入的试剂是____________;在第二个装置C的丙中,加入适量水,即制得氯水。向制得的氯水中加入过量的大理石,反应结束后将所得溶液分成四等分,进行I、Ⅱ、Ⅲ、Ⅳ四个实验,实验操作如下,将实验现象或者实验结论填入下表:
实验序号 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 将该溶液滴在有色布条上 | 有色布条迅速褪色 | ①该溶液中含有__________ |
Ⅱ | 向该溶液中滴加碳酸钠溶液 | ②___________ | 该溶液中含有Ca2+ |
Ⅲ | 向该溶液中滴加稀盐酸 | 有无色气泡产生 | ③无色气体是____________ |
Ⅳ | 加热该溶液 | 溶液变浑浊并产生大量气体 | ④该溶液中含有__________ |
⑤通过上述实验,得出氯水和过量的大理石反应的化学方程式为________________。