题目内容
10.下列关于物质的量浓度表述正确的是( )| A. | 0.3mol•L-1 的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9mol | |
| B. | 当1L水吸收22.4L氨气时所得氨水的浓度不是1mol•L-1,只有当22.4L氨气溶于水制得1L氨水时,其浓度才是1mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相等 | |
| D. | 10℃时,0.35mol/L的KCl饱和溶液100mL蒸发掉5g水,冷却到10℃时,其体积小于100mL,它的物质的量浓度仍为0.35mol/L |
分析 A、根据离子的物质的量=离子的物质的量浓度×溶液的体积;
B、根据溶液的体积不等于溶剂的体积以及气体摩尔体积与状态有关;
C、根据电荷守恒:c(Na+)+c(K+)=c(Cl-)+2c(SO42-)计算K+和Cl-的物质的量浓度;
D、根据温度不变,饱和溶液中溶质的物质的量浓度不变,与溶液的体积无关.
解答 解:A、0.3mol•L-1的Na2SO4溶液中Na+、SO42-的物质的量浓度为:0.6mol•L-1,0.3mol•L-1,由于缺少溶液的体积,所以无法计算出离子的物质的量,故A错误;
B、溶液的体积不等于溶剂的体积,所以1L水吸收22.4L氨气时所得氨水的浓度不是1mol•L-1;气体摩尔体积与状态有关,22.4L氨气的物质的量无法求出,所以22.4L氨气溶于水制得1L氨水时,其浓度不一定等于1mol•L-1,故B错误;
C、在K2SO4和NaCl的中性混合水溶液中存在:c(Na+)+c(K+)=c(Cl-)+2c(SO42-),Na+和SO42-的物质的量相等,即物质的量浓度相等,所以K+和Cl-的物质的量浓度一定不相同,故C错误;
D、10℃时,0.35mol/L的KCl饱和溶液100mL蒸发掉5g水,冷却到10℃时,其体积小于100 mL,溶液仍然是饱和溶液,溶质的物质的量浓度不变,它的物质的量浓度仍为0.35mol/L,故D正确;
故选:D.
点评 本题主要考查了饱和溶液、离子数目的计算、电荷守恒和物质的量浓度计算,难度不大,根据所学知识即可完成.

练习册系列答案
相关题目
18.一定量的Al2(SO4)3,ZnSO4,Na2SO4三种溶液分别与足量BaCl2溶液反应.若生成BaSO4沉淀质量比为1:2:3,则三种硫酸盐溶液的物质的量比为( )
| A. | 1:6:9 | B. | 1:2:3 | C. | 1:3:3 | D. | 1:3:6 |
5.下列反应中,反应物的量的相对多少都会影响反应产物,下列离子方程式正确的是( )
| A. | 少量CO2通入过量氨水中:NH3•H2O+CO2=${NH}_{4}^{+}$+${HCO}_{3}^{-}$ | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合加热:${HSO}_{3}^{-}$+OH-=${SO}_{3}^{2-}$+H2O | |
| C. | 溴化亚铁溶液中通入少量Cl2:Cl2+2Br-=2Cl-+Br2 | |
| D. | 含1mol KOH的溶液与含2mol Ba(HCO3)2的溶液混合:Ba2++${2HCO}_{3}^{-}$+2OH-=BaCO3↓+${CO}_{3}^{2-}$+2H2O |
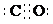 或
或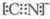 ;
;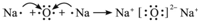 .
. .
.