题目内容
3.NA表示阿伏德罗常数的额值,下列说法正确的是( )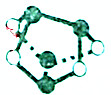
| A. | 5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| D. | 0.5mol雄黄(As4S4,结构如图),含有NA个As-S键 |
分析 A.铁与氯气反应生成三氯化铁,依据反应物少量的计算转移电子数;
B.铜与稀硫酸不反应;
C.过氧化钠中的阴离子为过氧根离子,硫化钠和过氧化钠的摩尔质量都是78g/mol;
D.As是ⅤA族元素,可以形成3个化学键、5个化学键,可以类比P,所以白色的是S,黑色的是As,依据图可知:1mol含有8个As-S键.
解答 解:A.5.6g铁粉物质的量为0.1mol,在0.1mol氯气反应生成氯化铁,氯气不足,反应转移电子0.2NA,故A错误;
B.12.5mL16mol/L浓硫酸中含溶质物质的量为0.2mol,与铜反应时,随反应进行浓度减小,变为稀硫酸后不再与铜反应,故转移要电子数小于0.2NA,故B错误;
C.7.8g Na2S和Na2O2的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,过氧化钠中阳离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数等于0.1NA,故C正确;
D.As是ⅤA族元素,可以形成3个化学键、5个化学键,可以类比P,所以白色的是S,黑色的是As,依据图可知:1mol含有8个As-S键,0.5mol雄黄(As4S4,结构如图),含有4NA个As-S键,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的应用,熟悉浓硫酸的性质、雄黄的结构是解题关键,题目难度不大.

练习册系列答案
 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
14.现有6瓶失去标签的液体,已知它们可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖中的一种.现通过如下实验来确定各试剂瓶中所装液体的名称:
(1)A的俗名为酒精,B中所含官能团的名称为羧基. D的结构简式为CH3COOCH2CH3.
(2)在D中加入NaOH溶液并加热的化学方程式为CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
(3)C的二氯代物有三种同分异构体;
(4)若将1mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在下并加热与足量乙酸充分反应.则生成的乙酸乙酯的质量大于88g(填:大于,小于或等于)
(5)已知乙醛发生银镜反的方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{加热}{→}$CH3COONH4+H2O+2Ag↓+3NH3,试写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+H2O+3NH3.
| 实验步骤和方法 | 实验现象 |
| ①把6瓶液体分别依次标号A、B、C、D、E、F,然后闻气味 | 只有F没有气味 |
| ②各取少量于试管中,加水稀释 | 只有C、D、E不溶解而浮在水面上 |
| ③分别取少量6种液体于试管中,加新制Cu(OH)并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
(2)在D中加入NaOH溶液并加热的化学方程式为CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
(3)C的二氯代物有三种同分异构体;
(4)若将1mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在下并加热与足量乙酸充分反应.则生成的乙酸乙酯的质量大于88g(填:大于,小于或等于)
(5)已知乙醛发生银镜反的方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{加热}{→}$CH3COONH4+H2O+2Ag↓+3NH3,试写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+H2O+3NH3.
11.下列关于阿伏伽德罗常数的叙述不正确的是( )
| A. | 阿伏伽德罗常数是指1mol物质中所含有的原子数 | |
| B. | 微粒的数目与物质的量成正比 | |
| C. | 国际上规定0.012kg12C中所含碳原子数为阿伏伽德罗常数 | |
| D. | 1mol O2中的分子数为NA,而原子数为2NA |
18.一定量的Al2(SO4)3,ZnSO4,Na2SO4三种溶液分别与足量BaCl2溶液反应.若生成BaSO4沉淀质量比为1:2:3,则三种硫酸盐溶液的物质的量比为( )
| A. | 1:6:9 | B. | 1:2:3 | C. | 1:3:3 | D. | 1:3:6 |
8.化工生产中用烷烃和氧气或水蒸气反应可得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨.对甲烷而言,有以下两个主要反应:
①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g);△H1=-36kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ•mol-1
(1)反应②中参加反应的CH4(g)与H2O(g)的总能量小于(填“大于”、“小于”或“等于”)生成的CO(g)与H2(g)的总能量.
(2)若氧气和水蒸气的混合气体中氧气的物质的量分数为x,请填写下列空白.
①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g);△H1=-36kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ•mol-1
(1)反应②中参加反应的CH4(g)与H2O(g)的总能量小于(填“大于”、“小于”或“等于”)生成的CO(g)与H2(g)的总能量.
(2)若氧气和水蒸气的混合气体中氧气的物质的量分数为x,请填写下列空白.
| 序号 | x(O2) | 与O2反应的 (Q1/kJ) | 与H2O反应的 (Q2/kJ) | 总反应的 (Q3/kJ) |
| I | 0.2 | -18 | ||
| Ⅱ | -36 | +72 |
12.下列叙述中正确的是( )
| A. | 实现H2→H+H的变化,要放出能量 | |
| B. | 液态水变成气态水要吸收能量 | |
| C. | 金刚石在一定条件变成石墨要吸收能量 | |
| D. | CaO和水反应过程中焓变大于0 |
 .
.