题目内容
7.固体(NH4)2 Al(SO4)2•12H2O在加热时,固体残留率随温度的变化如图所示.
(1)取A物质溶于水形成溶液,加入过量NaOH溶液混合加热,反应的离子方程式为NH4++Al3++5OH-$\frac{\underline{\;\;△\;\;}}{\;}$AlO2-+NH3↑+3H2O;
(2)B物质的化学式为Al2(SO4)3;
(3)取B物质,于975℃灼烧得到的主要产物是C和一种氧化性气体,该反应的化学方程式为Al2(SO4)3$\frac{\underline{\;975℃\;}}{\;}$Al2O3+3SO3↑,C与分别足量NaOH溶液和稀硫酸反应,消耗两者物质的量之比为2:3;
(4)常温下,在0.10mol•L-1B的溶液中加入氢氧化钠稀溶液充分搅拌有Al (OH)3沉淀生成,当溶液的pH=10时,c(Al3+)=3×10-22mol•L-1(KSp[Al (OH)3]=3×10-34).
分析 (1)分析固体残留率随温度的变化图可知,M(A)=M【NH4Al(SO4)2】×53.32%=237,故A为NH4Al(SO4)2;
(2)同理,M(B)=M【NH4Al(SO4)2】×37.75%=171,故其只可能是:2NH4Al(SO4)2~Al2(SO4)3,故B为Al2(SO4)3;
(3)M(C)=M【NH4Al(SO4)2】×11.26%=51,故其只可能是:2NH4Al(SO4)2~Al2O3,故C为Al2O3.NH4Al(SO4)2溶液,加入过量NaOH溶液混合加热,离子方程式为:NH4++Al3++5OH-$\frac{\underline{\;\;△\;\;}}{\;}$AlO2-+NH3↑+3H2O;B物质于975℃灼烧得到的氧化性气体为SO3;
(4)根据溶度积的概念可以直接计算.pH=10时,c(OH-)=10-4,由c(Al 3+)•c3(OH-)=KSp[Al(OH)3]可得C(Al 3+)=3×10-34/10-12=3×10-22.
解答 解:(1)分析固体残留率随温度的变化图可知,M(A)=M【NH4Al(SO4)2】×53.32%=237,故A为NH4Al(SO4)2,取A物质溶于水形成溶液,加入过量NaOH溶液混合加热,反应的离子方程式为:NH4++Al3++5OH-$\frac{\underline{\;\;△\;\;}}{\;}$AlO2-+NH3↑+3H2O,
故答案为:NH4++Al3++5OH-$\frac{\underline{\;\;△\;\;}}{\;}$AlO2-+NH3↑+3H2O;
(2)同理,M(B)=M【NH4Al(SO4)2】×37.75%=171,故其只可能是:2NH4Al(SO4)2~Al2O3,结合原子守恒得到B为Al2(SO4)3,
故答案为:Al2(SO4)3;
(3)M(C)=M【NH4Al(SO4)2】×11.26%=51,故其只可能是:2NH4Al(SO4)2~Al2O3,故C为Al2O3.NH4Al(SO4)2溶液,加入过量NaOH溶液混合加热,离子方程式为:NH4++Al3++5OH-$\frac{\underline{\;\;△\;\;}}{\;}$AlO2-+NH3↑+3H2O;B物质于975℃灼烧得到的氧化性气体为SO3,反应的化学方程式为:Al2(SO4)3$\frac{\underline{\;975℃\;}}{\;}$Al2O3+3SO3↑,C为Al2O3与分别足量NaOH溶液和稀硫酸反应,Al2O3+2NaOH=2NaAlO2+H2O,Al2O3+3H2SO4=Al2(SO4)2+3H2O,消耗两者物质的量之比为2:3,
故答案为:Al2(SO4)3$\frac{\underline{\;975℃\;}}{\;}$Al2O3+3SO3↑;2:3;
(4)根据溶度积的概念可以直接计算.pH=10时,c(OH-)=10-4,由c(Al 3+)•c3(OH-)=KSp[Al(OH)3],可得c(Al 3+)=$\frac{3×1{0}^{-34}}{1{0}^{-12}}$=3×10-22mol•L-1,
故答案为:3×10-22.
点评 本题考查了图象分析,固体加热分解产物的判断方法和计算应用,物质性质,溶度积常数的理解分析,掌握基础是关键,题目难度中等.

| A. | 1:6:9 | B. | 1:2:3 | C. | 1:3:3 | D. | 1:3:6 |
| A. | 实现H2→H+H的变化,要放出能量 | |
| B. | 液态水变成气态水要吸收能量 | |
| C. | 金刚石在一定条件变成石墨要吸收能量 | |
| D. | CaO和水反应过程中焓变大于0 |

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
②反应Ⅱ中反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
③实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
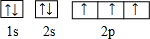 ,这样的排布遵循了泡利原理和洪特规则.
,这样的排布遵循了泡利原理和洪特规则.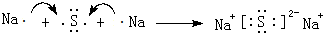 .
.