题目内容
7.(1)冶炼金属银采用热分解法,(2)冶炼金属锰采用热还原法.
分析 金属的冶炼一般有电解法、热还原法、热分解法、物理分离法
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:Hg、Ag用加热分解氧化物的方法制得,
物理分离法:Pt、Au用物理分离的方法制得.
解答 解:金属的冶炼一般有电解法、热还原法、热分解法、物理分离法
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:Hg、Ag用加热分解氧化物的方法制得,
物理分离法:Pt、Au用物理分离的方法制得,
(1)Ag属于较不活泼金属,采用热分解法冶炼,故答案为:热分解;
(2)Mn的还原性小于Al,且熔点较高,可以采用铝热反应冶炼,即热还原法冶炼,故答案为:热还原.
点评 本题考查金属的冶炼,明确金属活泼性强弱与冶炼方法的关系是解本题关键,根据金属活泼性强弱选取合适的冶炼方法,题目难度不大.

练习册系列答案
相关题目
17.已知燃烧7.80g乙炔气体生成二氧化碳气体和液态水时,放出389.9kJ的热量,则下列有关乙炔气体燃烧的热化学方程式中,正确的是( )
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-389.9kJ•mol-1 | |
| B. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+2599.2kJ•mol-1 | |
| C. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1299.6kJ•mol-1 | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-1299.6kJ•mol-1 |
15.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )
| A. | 使用Cu-Zn-Fe催化剂可大大提高CH3CH2OH的产率 | |
| B. | 反应需在300℃进行可推测出该反应为吸热反应 | |
| C. | 充入大量CO2气体可提高H2的转化率 | |
| D. | 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率 |
2.如图,表示正反应是吸热的是( )
| A. | 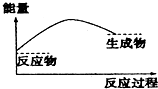 | B. | 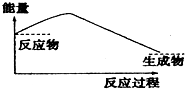 | ||
| C. | 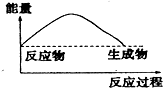 | D. |  |
12.下列关于元素周期表的说法正确的是( )
| A. | 短周期是指笫1、2周期 | B. | 过渡元素全部是金属元素 | ||
| C. | I A族的元索全部是金属元素 | D. | 元素周期表有8个副族 |
19.设NA伏加徳罗常数的值.下列叙述错误的是( )
| A. | 标准状况下,22.4 L CH4中含有分子的数目为NA | |
| B. | 标准状况下,2.24 L Cl2与足量铁反应,转移电子的数目为0.3NA | |
| C. | 常温常压下,46 g N02和N204混合气体中含有的原子数为3NA | |
| D. | 标准状况下,2.24 LC02与足量镁反应,转移电子的数目为0.4NA |
16.绿原酸的结构简式如图所示,下列有关绿原酸的说法不正确的是( )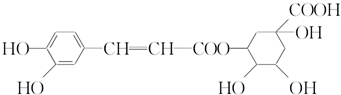
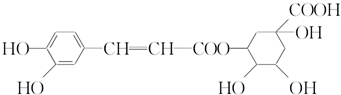
| A. | 分子式为C16H18O9 | |
| B. | 0.1 mol绿原酸最多与0.8 mol NaOH反应 | |
| C. | 能与Na2CO3反应 | |
| D. | 能发生取代反应和消去反应 |
17.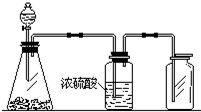 如图是一套实验制取气体的装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验制取气体的装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
 如图是一套实验制取气体的装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验制取气体的装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 制取NO气体 | B. | 制取二氧化碳气体 | ||
| C. | 制取氯气 | D. | 制取氨气 |