题目内容
6.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 常温常压下,17g烃基含有的电子总数为9N | |
| C. | 标准状况下,11.2LCH2CI2中含有的共价键数目为2N. | |
| D. | CH2=CH2和CH2=CHCH3的混合气体28g,完全燃烧后生成的CO2分子数目为2.5N |
分析 A、过氧化钠由2个钠离子和1个过氧根构成;
B、求出羟基的物质的量,然后根据1mol羟基含9mol电子来分析;
C、标况下,二氯甲烷为液态;
D、乙烯和丙烯的最简式均为CH2.
解答 解:A、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠由2个钠离子和1个过氧根构成,故0.1mol过氧化钠中共含0.3mol离子即0.3NA个,故A错误;
B、17g羟基的物质的量为1mol,而1mol羟基含9mol电子,即9NA个,故B正确;
C、标况下,二氯甲烷为液态,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、乙烯和丙烯的最简式均为CH2,故28g混合物中含有的CH2的物质的量n=$\frac{28g}{14g/mol}$=2mol,即含2mol碳原子,则燃烧后生成的二氧化碳的物质的量为2mol,即二氧化碳分子数为2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数数的有关计算,掌握公式的应用和物质的结构是解题关键,难度不大.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
17.已知燃烧7.80g乙炔气体生成二氧化碳气体和液态水时,放出389.9kJ的热量,则下列有关乙炔气体燃烧的热化学方程式中,正确的是( )
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-389.9kJ•mol-1 | |
| B. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+2599.2kJ•mol-1 | |
| C. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1299.6kJ•mol-1 | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-1299.6kJ•mol-1 |
14.糖类、蛋白质、油脂是人体重要的营养物质,下列有关说法不正确的是( )
| A. | 麦芽糖在人体内的水解产物能和银氨溶液发生反应 | |
| B. | 在鸡蛋清溶液中加入饱和的Na2SO4溶液时,会使蛋白质析出 | |
| C. | 淀粉、纤维素、蛋白质和油脂都是有机高分子化合物 | |
| D. | 在一定条件下氨基酸之间能发生反应,合成更复杂的化合物(多肽),构成蛋白质 |
1.已知C2H2(g)+$\frac{5}{2}$O2(g)→2CO2(g)+H2O(l)△H=-1300kJ•mol-1,则下列说法正确的是( )
| A. | 若生成NA个水蒸气分子反应热为△H0,则△H0<△H | |
| B. | 当有20NA个电子转移时,放出2600kJ 热量 | |
| C. | 当有4NA个碳氧共用电子对生成时,放出1300kJ热量 | |
| D. | 上述反应为吸热反应 |
11.元素在周期表中的位置反映了元素的原子结构和元素的性质,下列说法错误的是( )
| A. | 元素周期表中位于金属与非金属分界线附近的元素,既表现金属性,又表现非金属性 | |
| B. | 同主族元素的原子,最外层电子数相同,化学性质相似 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 第三周期主族元素的最高正化合价都等于它的族序数 |
15.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )
| A. | 使用Cu-Zn-Fe催化剂可大大提高CH3CH2OH的产率 | |
| B. | 反应需在300℃进行可推测出该反应为吸热反应 | |
| C. | 充入大量CO2气体可提高H2的转化率 | |
| D. | 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率 |
16.绿原酸的结构简式如图所示,下列有关绿原酸的说法不正确的是( )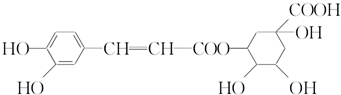
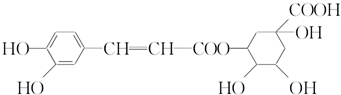
| A. | 分子式为C16H18O9 | |
| B. | 0.1 mol绿原酸最多与0.8 mol NaOH反应 | |
| C. | 能与Na2CO3反应 | |
| D. | 能发生取代反应和消去反应 |
 镁化合物具有广泛用途,请回答有关镁的下列问题:
镁化合物具有广泛用途,请回答有关镁的下列问题: