题目内容
3.煤和石油燃烧生成的二氧化硫是形成酸雨的主要物质,它在空气中可能发生的反应如下:①SO2+H2O?H2SO3;②2H2SO3+O2→2H2SO4(1)上述反应中属于氧化还原反应的是②(填反应序号).
(2)该氧化还原反应中被氧化的元素是S,氧化剂是O2.
(3)在上述相应的氧化还原反应的化学方程式上标出电子转移的方向和数目.
分析 (1)有元素化合价的变化的反应属于氧化还原反应;
(2)元素的化合价升高被氧化,化合价降低作氧化剂;
(3)反应中S的化合价从+4价升高到+6价失电子,O从0价降低到-2价得电子.
解答 解:(1)有元素化合价的变化的反应属于氧化还原反应,①SO2+H2O?H2SO3属于非氧化还原反应,②2H2SO3+O2→2H2SO4,O、S元素的化合价发生变化属于氧化还原反应;
故答案为:②;
(2)2H2SO3+O2=2H2SO4反应中S元素的化合价升高被氧化,O2中O元素的化合价降低作氧化剂;
故答案为:S;O2;
(3)反应中S的化合价从+4价升高到+6价失电子,O元素的化合价从0价降低到-2价得电子,反应中共转移4个电子,电子转移的方向和数目为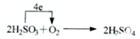 ;
;
故答案为: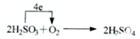 .
.
点评 本题考查氧化还原反应,侧重于学生的分析能力和基本概念的理解和运用的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
14.糖类、蛋白质、油脂是人体重要的营养物质,下列有关说法不正确的是( )
| A. | 麦芽糖在人体内的水解产物能和银氨溶液发生反应 | |
| B. | 在鸡蛋清溶液中加入饱和的Na2SO4溶液时,会使蛋白质析出 | |
| C. | 淀粉、纤维素、蛋白质和油脂都是有机高分子化合物 | |
| D. | 在一定条件下氨基酸之间能发生反应,合成更复杂的化合物(多肽),构成蛋白质 |
11.元素在周期表中的位置反映了元素的原子结构和元素的性质,下列说法错误的是( )
| A. | 元素周期表中位于金属与非金属分界线附近的元素,既表现金属性,又表现非金属性 | |
| B. | 同主族元素的原子,最外层电子数相同,化学性质相似 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 第三周期主族元素的最高正化合价都等于它的族序数 |
15.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )
| A. | 使用Cu-Zn-Fe催化剂可大大提高CH3CH2OH的产率 | |
| B. | 反应需在300℃进行可推测出该反应为吸热反应 | |
| C. | 充入大量CO2气体可提高H2的转化率 | |
| D. | 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率 |
12.下列关于元素周期表的说法正确的是( )
| A. | 短周期是指笫1、2周期 | B. | 过渡元素全部是金属元素 | ||
| C. | I A族的元索全部是金属元素 | D. | 元素周期表有8个副族 |
13.短周期元素X、Y、Z在周期表中的相对位置如图所示,则下列说法正确的是( )


| A. | Z的最高价氧化物的水化物是强酸 | |
| B. | Y是气态氢化物稳定性小于Z的气态氢化物 | |
| C. | Z一定是活泼的金属 | |
| D. | 1molZ单质在足量的氧气中燃烧时,有6mol电子发生转移 |


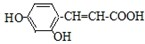 .
. .
.