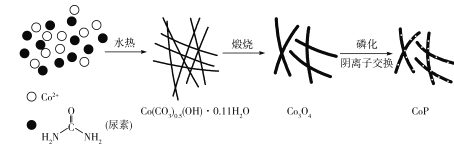
题目内容
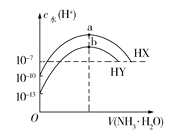
【题目】25℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,错误的是
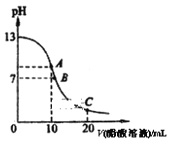
A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点:c(OH-)=c(H+)<c(Na+)=c(CH3COO-)
C.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.在A、B、C点:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
【答案】A
【解析】
酸浓度是碱的2倍,要使二者恰好完全中和时,NaOH体积是醋酸的2倍,根据图知,A点溶液中溶质为CH3COONa,B点溶液呈中性,溶质为醋酸钠和醋酸,C点溶质为等物质的量浓度的醋酸钠和醋酸。
A.A点溶质为醋酸钠,醋酸钠水解导致溶液呈碱性,c(OH-)>c(H+),但是醋酸根离子水解程度较小,所以存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故A错误;
B.B点溶液呈中性,c(OH-)=c(H+),根据电荷守恒得c(Na+)═c(CH3COO-),醋酸根水解程度较弱,所以c(OH-)=c(H+)<c(Na+)=c(CH3COO-),故B正确;
C.C点溶质为等物质的量浓度的醋酸钠和醋酸,溶液中存在物料守恒c(CH3COO-)+c(CH3COOH)═2c(Na+),故C正确;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)═c(OH-)+c(CH3COO-),故D正确;
故选:A。

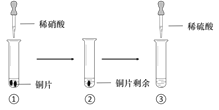
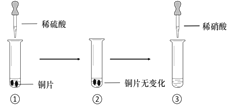
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1 | 实验2 |
|
|
①、③中溶液呈蓝色,试管口有红棕色气体产生 | ③中溶液呈蓝色,试管口有红棕色气体产生 |
下列说法正确的是
A. 稀硝酸一定被还原为NO2
B. 实验1-②中溶液存在:c(Cu2+) + c(H+) =c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. 实验1-③、实验2-③中反应的离子方程式:3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O