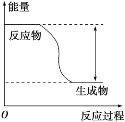
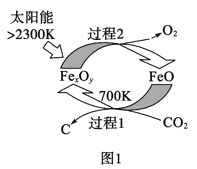
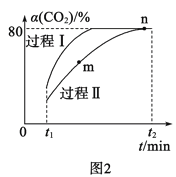
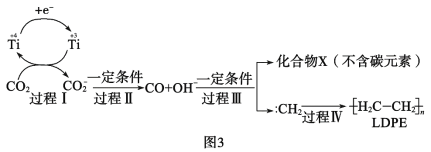
题目内容
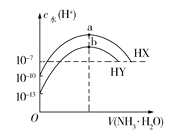
【题目】25℃时,分别向浓度均为0.1 mol/L,体积均为20 mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是
A. HX的电离方程式为HX![]() H++X
H++X
B. b点时溶液中c(![]() )=c(Y)>c(H+)=c(OH)
)=c(Y)>c(H+)=c(OH)
C. HX的电离平衡常数约为1×107 mol/L
D. a、b两点对应溶液中存在的微粒种类数目相同
【答案】C
【解析】由图中看出0.1 mol/L的HY溶液中,由水电离出的c(H+)=1×1013 mol/L,可知HY为强酸,HX为弱酸,其电离方程式为HX![]() H++X,A错误;b点时水的电离程度最大,说明NH3·H2O和HY恰好反应,溶质为NH4Y,由于
H++X,A错误;b点时水的电离程度最大,说明NH3·H2O和HY恰好反应,溶质为NH4Y,由于![]() 的水解溶液显酸性,故c(Y)>c(
的水解溶液显酸性,故c(Y)>c(![]() )>c(H+)>c(OH),B错误;HX溶液中由HX电离出的c(H+)=1×104 mol/L,则其电离平衡常数K=
)>c(H+)>c(OH),B错误;HX溶液中由HX电离出的c(H+)=1×104 mol/L,则其电离平衡常数K=![]() ≈
≈![]() =1×107 mol/L,C正确;a点溶质为NH4X,但由于
=1×107 mol/L,C正确;a点溶质为NH4X,但由于![]() 和X均水解,溶液中存在
和X均水解,溶液中存在![]() 、NH3·H2O、X、HX、H+、OH和H2O共7种微粒;b点溶质为NH4Y,只有
、NH3·H2O、X、HX、H+、OH和H2O共7种微粒;b点溶质为NH4Y,只有![]() 水解,溶液中存在
水解,溶液中存在![]() 、NH3·H2O、Y、H+、OH和H2O共6种微粒,D错误
、NH3·H2O、Y、H+、OH和H2O共6种微粒,D错误

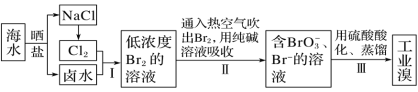
【题目】X、Y、Z、R、W为常见的主族元素,根据下表信息回答问题:
元素 | 元素性质或原子结构信息 |
X | 短周期元素原子半径最大(稀有气体元素不参与比较) |
Y | +3价阳离子的核外电子排布与氖原子相同 |
Z | 原子核外M电子层与K电子层的电子数相等 |
R | 与Z同周期,主要化合价为1、+7 |
W | 原子结构示意图: |
(1)写出元素X的原子结构示意图_____;元素W在周期表中位置_____。
(2)Y、Z最高价氧化物对应水化物的碱性强弱比较_____>_____(填化学式)。
(3)用电子式表示X和R形成化合物的过程:_____。
(4)下列对于W及其化合物的推断中,正确的是_____(填序号)。
①W的最低负化合价与R的最低负化合价相同
②W的氢化物的稳定性弱于R的氢化物的稳定性
③W的单质可与X和R形成的化合物的水溶液发生置换反应
④W的最高价氧化物对应水化物的酸性比R的强
(5)为验证卤族部分元素单质氧化性的递变规律,设计如图装置进行实验,请回答:
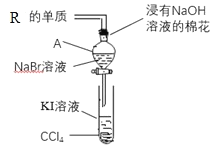
①A中发生的反应的离子方程式是_____。
②棉花中浸有的NaOH溶液的作用是_____(用离子方程式表示)。
③为验证Br2与I2的氧化性强弱:通入一定量R的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到_____。该实验必须控制加入的R单质的量,否则得不出Br2的氧化性比I2强。理由是______。
④从原子结构的角度解释卤族元素单质氧化性逐渐减弱的原因:______。