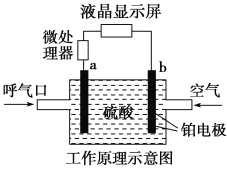
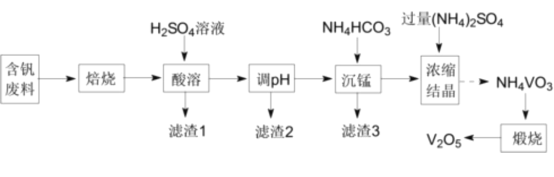
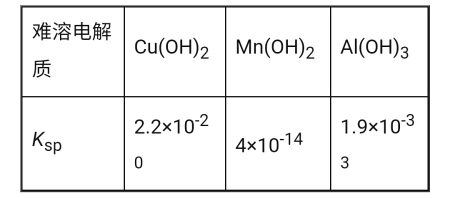
题目内容
【题目】甲~庚等元素在周期表中的相对位置如表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是( )
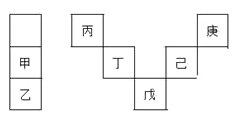
A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物为分子晶体,可用于制造光导纤维
【答案】A
【解析】
由己的最高价氧化物对应水化物有强脱水性可知,己为S元素;由甲原子最外层与最内层具有相同电子数、甲与S在同一周期可知,甲为Mg元素。根据元素周期表的位置推知,丁为硅元素,乙为钙元素,丙为硼元素,戊为砷元素,庚为氟元素。
A.丙的原子序数为5,戊的原子序数为33,相差28,A正确;
B.元素周期表中从左到右、从下到上,气态氢化的稳定性越来越强,故应为庚>己>戊,B错误;
C.常温下镁与水不能剧烈反应,C错误;
D.二氧化硅为原子晶体,可用于制造光导纤维,D错误;
答案选A。

练习册系列答案
相关题目
【题目】一定温度下,在三个容积均为 1.0L 的恒容密闭容器中发生反应: CH3OH(g)+CO(g) CH3COOH(g) △H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 乙酸的平衡浓度/ mol/L | 平衡常数 | ||
c(CH3OH) | c(CH3OH) | c(CH3COOH) | c(CH3COOH) | |||
I | 530 | 0.50 | 0.5 | 0 | 0..40 | K1 |
II | 530 | 0.20 | 0.2 | 0.4 | K2 | |
III | 510 | 0 | 0 | 0.5 | K3 | |
A.三个容器中的平衡常数 K1<K2< K3
B.达平衡时,容器I与容器II中的总压强之比为3 : 4
C.达平衡时,容器I中CH3OH转化率与容器 III 中CH3COOH转化率之和小于l
D.达平衡时,容器III中的正反应速率比容器I中的大