题目内容
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.2.8g14N2与14C16O的混合物中,中子数目为 l.4NA
B.含 0. l molFeCl3的溶液与0. l mol 锌充分反应,转移电子数为0.l NA
C.标准状况下,5.6gC4H8中 C-C 的数目可能为0.4NA
D.某温度下,1LpH=9 的 Na2CO3 溶液中,水电离产生的OH-数目为10-5 NA
【答案】C
【解析】
A. 14N2的摩尔质量为28g/mol,一个分子中有14个中子,14C16O的摩尔质量为30g/mol,一个分子中有16个中子,二者的的摩尔质量和中子数都不同,2.8g混合物中,中子数目不为 l.4NA,故A错误;
B.含 0. l molFeCl3的溶液与0. l mol 锌充分反应,方程式为Zn+2Fe3+=Zn2++2Fe2+,锌过量,0. l mol FeCl3完全反应转化为0. l mol FeCl2,消耗0.05molZn,过量的锌继续与亚铁离子反应,Zn+Fe2+=Zn2++Fe,剩余0.05mol锌只能消耗0.05mol FeCl2,即氯化亚铁过量,整个过程中,0.1mol的锌完全反应,转移电子数为0.1mol×2×NA=0.2NA,故B错误;
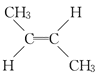
C.5.6gC4H8的物质的量为0.1mol,符合分子式C4H8的有机物有多种同分异构体:CH2=CH-CH2CH3、CH2=C(CH3)2、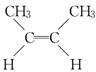 、
、 、环丁烷(
、环丁烷( )、甲基环丙烷(
)、甲基环丙烷(![]() ),若有机物的结构为环丁烷、甲基环丙烷时,C-C 的数目为0.4NA,故C正确;
),若有机物的结构为环丁烷、甲基环丙烷时,C-C 的数目为0.4NA,故C正确;
D.某温度下,1LpH=9 的 Na2CO3 溶液中氢离子浓度为10-9mol/L,溶液中的氢氧根离子来自水的电离,但溶液温度未知,无法使用水的离子积常数计算,故D错误;
答案选C。

 轻巧夺冠周测月考直通中考系列答案
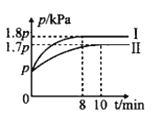
轻巧夺冠周测月考直通中考系列答案【题目】某研究小组为探究弱酸性条件下铁发生电化学腐蚀的类型及腐蚀速率,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞,如图 1 所示。 从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
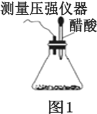
(1)请完成以下实验设计(完成表中空格):
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | ______________ | 0.5 | ____________ | 36.0 |
③ | 碳粉含量的影响 | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图 2。 t2 时,容器中压强明显小于起始压强, 其原因是铁发生了_____腐蚀, 请在图 3 中用箭头标出发生该腐蚀时电子流动方向_____;此时,碳粉表面发生了_____(填“氧化”或“还原”)反应,其电极反应式是_____。
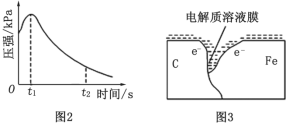
(3)该小组对图 2 中 0~t1 时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:_____。
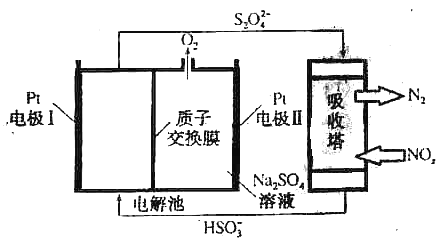
【题目】利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧锌铁皮的作用有_________________________________________。
A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是______________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,原因是___________________。
(4)Fe3O4胶体粒子能否用减压过滤发实现固液分离?____________(填“能”或“不能”),理由是_________________________________________________。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取_______g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。
配制该标准溶液时,下列仪器中不必要用到的有_____________。(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将__________(填“偏大”、“偏小”或“不变”)。