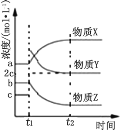
题目内容
【题目】一定温度下,在三个容积均为 1.0L 的恒容密闭容器中发生反应: CH3OH(g)+CO(g) CH3COOH(g) △H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 乙酸的平衡浓度/ mol/L | 平衡常数 | ||
c(CH3OH) | c(CH3OH) | c(CH3COOH) | c(CH3COOH) | |||
I | 530 | 0.50 | 0.5 | 0 | 0..40 | K1 |
II | 530 | 0.20 | 0.2 | 0.4 | K2 | |
III | 510 | 0 | 0 | 0.5 | K3 | |
A.三个容器中的平衡常数 K1<K2< K3
B.达平衡时,容器I与容器II中的总压强之比为3 : 4
C.达平衡时,容器I中CH3OH转化率与容器 III 中CH3COOH转化率之和小于l
D.达平衡时,容器III中的正反应速率比容器I中的大
【答案】C
【解析】
A.平衡常数只于温度有关,温度不变平衡常数不变,则 K1=K2,反应体系△H<0,降低温度,平衡正向移动,平衡常数增大,则K1=K2< K3,故A错误;
B.根据理想气体状态方程pV=nRT,容器为恒容装置,V不变,则有p=cRT,容器Ⅰ与容器Ⅱ温度相同,则体系压强与体系中反应物总浓度成正比,温度不变,化学平衡常数不变,容器Ⅰ中平衡时c(CH3OH)=0.5mol/L0.4mol/L=0.1mol/L,c(CO)=0.5mol/L0.4mol/L=0.1mol/L,c(CH3COOH)=0.4mol/L,K=![]() =
=![]() =40,设容器Ⅱ反应到达平衡时CH3OH转化cmol/L,所以达平衡时,容器I与容器II中的总压强之比为=
=40,设容器Ⅱ反应到达平衡时CH3OH转化cmol/L,所以达平衡时,容器I与容器II中的总压强之比为=![]() =
=![]() =
=![]() ,容器ⅡQc=
,容器ⅡQc=![]() =10<K=40,可知容器Ⅱ中反应向右进行,则c为正值,所以达平衡时,容器I与容器II中的总压强之比大于3:4,故B错误;
=10<K=40,可知容器Ⅱ中反应向右进行,则c为正值,所以达平衡时,容器I与容器II中的总压强之比大于3:4,故B错误;
C.容器Ⅲ与容器Ⅰ刚好为互为逆反应过程,对于容器I,容器I中CH3OH转化率容器Ⅰ中CH3COOH转化率之和刚好为1,容器Ⅲ温度低于容器I,正反应为放热反应,温度降低对正反应有利,所以容器Ⅲ中CH3COOH转化率低于容器Ⅰ以等量CH3COOH起始时的CH3COOH转化率,所以达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1,故C正确;
D.容器Ⅲ与容器Ⅰ刚好互为逆反应过程,但容器Ⅰ温度高于容器Ⅲ,温度越高,化学反应速率越大,所以达到化学平衡时容器III中的正反应速率比容器I中的小,故D错误;
答案选C。

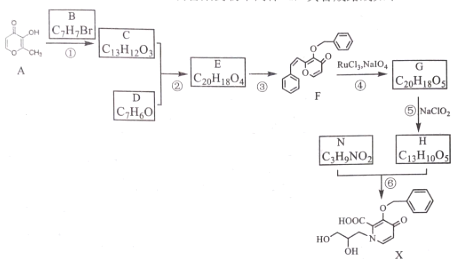
【题目】利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧锌铁皮的作用有_________________________________________。
A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是______________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,原因是___________________。
(4)Fe3O4胶体粒子能否用减压过滤发实现固液分离?____________(填“能”或“不能”),理由是_________________________________________________。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取_______g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。
配制该标准溶液时,下列仪器中不必要用到的有_____________。(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将__________(填“偏大”、“偏小”或“不变”)。