题目内容
【题目】常温下,下列说法正确的是
A.pH 相等的盐酸和醋酸,加水稀释相同倍数后,c(Cl-)=c(CH3COO- )
B.0.l molL-1 氨水的p H= a,加入适量的氯化铵固体可使溶液pH= a+ l
C.物质的量浓度相等的 (NH4)2SO4 溶液与(NH4) 2CO3溶液中, 前者大于后者
前者大于后者
D.等物质的量浓度等体积的醋酸溶液和氢氟酸溶液,与足量氢氧化钠反应,放出的热量相等
【答案】C
【解析】
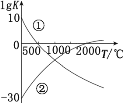
A.pH相等的盐酸和醋酸中c(Cl-)=c(CH3COO-),加水稀释时,由于醋酸弱电解质的电离平衡向右移动,使c(Cl-)<c(CH3COO-),故A错误;
B.0.l molL-1 氨水的p H= a,加入适量的氯化铵固体,溶液中铵根离子浓度增大,氨水电离平衡逆向移动,氢氧根离子浓度减小,溶液的pH值减小,故B错误;
C.物质的量浓度相等的 (NH4)2SO4 溶液中铵根离子水解,硫酸根离子对铵根离子水解无影响,(NH4) 2CO3溶液中铵根离子和碳酸根离子都水解,碳酸根促进铵根离子的水解,铵根离子浓度减小,一水合氨离子浓度增大,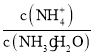 减小,故前者大于后者,故C正确;
减小,故前者大于后者,故C正确;
D.等物质的量醋酸和氢氟酸都属于弱电解质,电离时电离程度不同,吸收的热量不同,与足量氢氧化钠反应,放出的热量不相等,故D错误;

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】某研究小组为探究弱酸性条件下铁发生电化学腐蚀的类型及腐蚀速率,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞,如图 1 所示。 从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
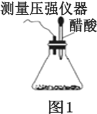
(1)请完成以下实验设计(完成表中空格):
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | ______________ | 0.5 | ____________ | 36.0 |
③ | 碳粉含量的影响 | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图 2。 t2 时,容器中压强明显小于起始压强, 其原因是铁发生了_____腐蚀, 请在图 3 中用箭头标出发生该腐蚀时电子流动方向_____;此时,碳粉表面发生了_____(填“氧化”或“还原”)反应,其电极反应式是_____。
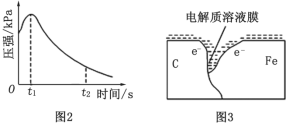
(3)该小组对图 2 中 0~t1 时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:_____。
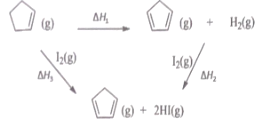
【题目】环戊二烯之(![]() ) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
共价键 | 键能/ |
H-H | 436 |
H-I | 299 |
I-I | 151 |
A.△H1+△H2+△H3=0
B.△H1<△H3
C.![]() (g)转化为
(g)转化为![]() (g)的过程中,有C-H的断裂和形成
(g)的过程中,有C-H的断裂和形成
D.在相同条件下,生成 2molHCl(g) 的△H2′<△H2