题目内容
【题目】五氧化二钒(V2O5)为强氧化剂,易被还原成各种低价氧化物,在工业生产中常用作催化剂,即触媒。实验室以含钒废料(含V2O3、CuO、MnO、SiO2、Al2O3、有机物)为原料制备V2O5的一种流程如图:
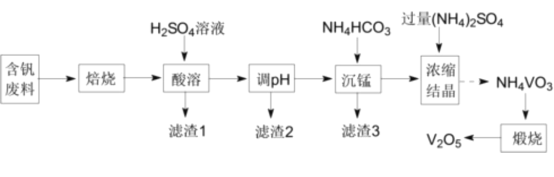
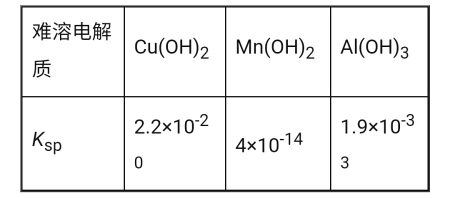
已知I.25℃时,难溶电解质的溶度积常数如表所示:
II.NH4VO3在水中的溶解度:20℃、4.8g·L-1;60℃、24.2g·L-1。
回答下列问题:
(1)“焙烧”的目的是__。
(2)“滤渣1”的用途为__(写出一种即可)。
(3)滤渣2成分为__。通过列式计算说明,常温下,若“调pH”为6,Cu2+是否沉淀完全__。(溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全)
(4)“沉锰”需将温度控制在70°C左右,温度不能过高或过低的原因为___。
(5)滤渣3成分为MnCO3,请写出“沉锰”的离子方程式__。
(6)V2O5最重要的应用是在接触法制硫酸时,作SO2氧化为SO3的催化剂。该催化反应中VO2为中间产物,请用化学方程式表示该催化过程:__、__。
【答案】除去有机物,将V2O3氧化成V2O5 制坩埚、制光导纤维、制玻璃(写出一种即可) Al(OH)3、Cu(OH)2 pH=6时,c(H+)=10-6mol/L,c(OH-)=![]() mol/L=10-8mol/L,因为Ksp[Cu(OH)2]=2.2×10-20,此时有:c(Cu2+)×(10-8)2=2.2×10-20,c(Cu2+)=
mol/L=10-8mol/L,因为Ksp[Cu(OH)2]=2.2×10-20,此时有:c(Cu2+)×(10-8)2=2.2×10-20,c(Cu2+)=![]() =2.2×10-4﹥10-5,所以未完全沉淀 温度过高,碳酸氢铵分解,原料利用率低,温度过低,反应速率慢,NH4VO3可能提前析出导致产率低 2HCO3-+Mn2+=MnCO3↓+H2O+CO2↑ V2O5+SO2= 2VO2+SO3 4VO2+O2=2V2O5
=2.2×10-4﹥10-5,所以未完全沉淀 温度过高,碳酸氢铵分解,原料利用率低,温度过低,反应速率慢,NH4VO3可能提前析出导致产率低 2HCO3-+Mn2+=MnCO3↓+H2O+CO2↑ V2O5+SO2= 2VO2+SO3 4VO2+O2=2V2O5
【解析】
将钒废料(含V2O3、CuO、MnO、SiO2、Al2O3、有机物)进行焙烧除去有机物,加硫酸进行溶解,SiO2不溶于硫酸,过滤除去,加合适的药品调pH除去Cu2+和Al3+,接下来利用碳酸氢铵把Mn2+沉淀,然后过滤除去,加硫酸铵得到硫酸铵和NH4VO3的混合溶液,利用溶解性不同浓缩结晶后过滤得到NH4VO3,煅烧NH4VO3得到V2O5,据此分析解得。
(1)一方面,通过焙烧,有机物燃烧除去了,另一方面,从整个流程看,在没有加氧化剂的情况下V从V2O3中的+3价变成了最后的+5价,所以焙烧还有一个目的,将V2O3氧化成V2O5,故答案为:除去有机物,将V2O3氧化成V2O5;
(2)由分析可得出“滤渣1”主要成分是二氧化硅,可以用来制坩埚、制光导纤维、制玻璃等,故答案为:制坩埚、制光导纤维、制玻璃(写出一种即可);
(3)对比调pH前后,溶液中少了Cu2+和Al3+,说明Cu2+和Al3+被沉淀除去了,所以滤渣2成分为:Al(OH)3、Cu(OH)2。pH=6时,c(H+)=10-6mol/L,c(OH-)=![]() mol/L=10-8mol/L,因为Ksp[Cu(OH)2]=2.2×10-20,此时有:c(Cu2+)×(10-8)2=2.2×10-20,c(Cu2+)=
mol/L=10-8mol/L,因为Ksp[Cu(OH)2]=2.2×10-20,此时有:c(Cu2+)×(10-8)2=2.2×10-20,c(Cu2+)=![]() =2.2×10-4﹥10-5,所以未完全沉淀,故答案为:Al(OH)3、Cu(OH)2;pH=6时,c(H+)=10-6mol/L,c(OH-)=
=2.2×10-4﹥10-5,所以未完全沉淀,故答案为:Al(OH)3、Cu(OH)2;pH=6时,c(H+)=10-6mol/L,c(OH-)=![]() mol/L=10-8mol/L,因为Ksp[Cu(OH)2]=2.2×10-20,此时有:c(Cu2+)×(10-8)2=2.2×10-20,c(Cu2+)=
mol/L=10-8mol/L,因为Ksp[Cu(OH)2]=2.2×10-20,此时有:c(Cu2+)×(10-8)2=2.2×10-20,c(Cu2+)=![]() 2.2×10-4﹥10-5,所以未完全沉淀;
2.2×10-4﹥10-5,所以未完全沉淀;
(4)温度过高,碳酸氢铵分解,原料利用率低,温度过低,反应速率慢,NH4VO3可能提前析出导致产率低,故答案为:温度过高,碳酸氢铵分解,原料利用率低,温度过低,反应速率慢,NH4VO3可能提前析出导致产率低;
(5)根据电荷守恒有:2HCO3-+Mn2+=MnCO3↓+H2O+CO2↑,故答案为:2HCO3-+Mn2+=MnCO3↓+H2O+CO2↑;
(6)VO2是中间产物,从V2O5到VO2,V从+5价降低到+4价,被还原,SO2做还原剂,自身被氧化成SO3,所以第一步为V2O5+SO2= 2VO2+SO3,接下来,

 寒假学与练系列答案
寒假学与练系列答案【题目】某研究小组为探究弱酸性条件下铁发生电化学腐蚀的类型及腐蚀速率,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞,如图 1 所示。 从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
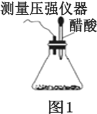
(1)请完成以下实验设计(完成表中空格):
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | ______________ | 0.5 | ____________ | 36.0 |
③ | 碳粉含量的影响 | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图 2。 t2 时,容器中压强明显小于起始压强, 其原因是铁发生了_____腐蚀, 请在图 3 中用箭头标出发生该腐蚀时电子流动方向_____;此时,碳粉表面发生了_____(填“氧化”或“还原”)反应,其电极反应式是_____。
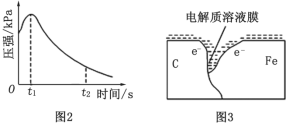
(3)该小组对图 2 中 0~t1 时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:_____。