题目内容
【题目】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3) 2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
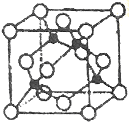
①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
【答案】(1)[Ar]3d9(2)正四面体;CCl4等;HClO4有3个非羟基氧,而HClO2有1个非羟基氧;
(3)sp2;11NA(4)A(5)①CuCl;②共价;③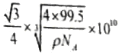
【解析】
试题分析:周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子,R为C元素。工业上通过分离液态空气获得X单质,X为O元素,则W为N元素。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和,则Y为Cl元素。Z基态原子的最外能层只有一个电子,其他能层均己充满电子,Z为Cu元素。
(1) Z为Cu元素。铜为29号元素,Z2+基态核外电子排布式为[Ar]3d9,故答案为:[Ar]3d9;
(2) YX4-为ClO4-,其中Cl的孤电子对数目为![]() (7+1-4×2)=0,连接的原子数目为4,采取sp3杂化,空间构型是正四面体;与YX4-互为等电子体的分子有CCl4;HClO4有3个非羟基氧,而HClO2有1个非羟基氧,使得HClO4酸性比HClO2强,故答案为:正四面体;CCl4等;HClO4有3个非羟基氧,而HClO2有1个非羟基氧;
(7+1-4×2)=0,连接的原子数目为4,采取sp3杂化,空间构型是正四面体;与YX4-互为等电子体的分子有CCl4;HClO4有3个非羟基氧,而HClO2有1个非羟基氧,使得HClO4酸性比HClO2强,故答案为:正四面体;CCl4等;HClO4有3个非羟基氧,而HClO2有1个非羟基氧;
(3)结构简式为CO (N2H3)2的结构为![]() ,其中C原子上连接有3个原子,没有孤电子对,采取sp2杂化,lmo1 CO (N2H3)2分子中含有σ键数目为11NA,故答案为:sp2;11NA
,其中C原子上连接有3个原子,没有孤电子对,采取sp2杂化,lmo1 CO (N2H3)2分子中含有σ键数目为11NA,故答案为:sp2;11NA
(4)往硫酸铜溶液中通入过量的NH3,可生成[Cu(NH3)4]SO4,A. [Cu(NH3)4]SO4属于离子化合物,所含的化学键有离子键、硫酸根离子和氨分子中存在极性键和铜离子和N原子间存在配位键,故A正确;B.在[Cu(NH3)4]2+中Cu2+提供空轨道给出孤对电子,NH3给出孤对电子,故B错误;C.在[Cu(NH3)4]SO4组成元素中第一电离能最大的是氮元素,因为氮的2p为半充满结构,故C错误;故选A;
(5)①该晶体中Cu原子数目为4,Cl原子数目为8×![]() +6×
+6×![]() =4,故化学式为CuCl,故答案为:CuCl;
=4,故化学式为CuCl,故答案为:CuCl;
②已知Z和Y的电负性分别为1.9和3.0,电负性的差值为1.1<1.8,则Y与L形成的化合物属于共价化合物,故答案为:共价;
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶胞的边长为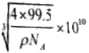 cm,该晶体中Cu原子和Cl原子之间的最短距离为体对角线的
cm,该晶体中Cu原子和Cl原子之间的最短距离为体对角线的![]() ,即
,即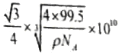 cm,故答案为:
cm,故答案为: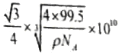 。
。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案