题目内容
1.利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示: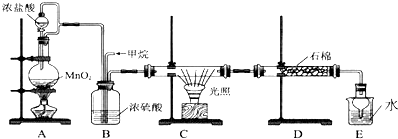
(1)A中制取Cl2反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)D中石棉吸附了润湿的KI粉末,以除去过量的Cl2,其颜色变化为变紫色.
(3)E装置用于吸收生成的HCl,其中的干燥管除导气以外,还起着防止倒吸的作用.
(4)E装置中除了有盐酸生成外,还含有甲烷的其它氯代产物,从E中分离出盐酸和其它氯代甲烷的方法是分液.
(5)将l mol CH4与C12发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是2.5mol.
分析 (1)MnO2能将HCl(浓)氧化为MnCl2和Cl2;
(2)氯气具有强氧化性,能将碘离子氧化生成碘单质;
(3)HCl极易溶于水,需要防止倒吸;
(4)盐酸和有机物不能互溶,所以可以采用分液的方法分离;
(5)根据四种取代物的物质的量相等结合碳原子守恒计算取代物的物质的量,再根据被取代的氢原子和氯气分子之间的关系式计算消耗氯气的物质的量.
解答 解:甲烷与氯气在光照的条件下发生取代反应生成多种氯代甲烷和氯化氢.A装置是浓盐酸和二氧化锰制取氯气的发生装置,通过B装置,除去氯气中的水蒸气,控制两种气体的流速,使氯气和甲烷混合均匀,C装置是甲烷和氯气发生取代反应的装置,D装置盛有湿润的KI粉末可以用来除去过量的氯气,尾气中含有有毒气体CH3Cl和过量的甲烷,容易污染空气,需要进行尾气处理.
(1)MnO2能将HCl(浓)氧化为MnCl2和Cl2,A中制取Cl2反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)氯气具有强氧化性,能氧化碘离子为碘单质,发生反应:2KI+Cl2=2KCl+I2,碘为紫色,故答案为:变紫色;
(3)HCl极易溶于水易发生倒吸,所以E还可以防止倒吸,故答案为:防止倒吸;
(4)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开,故答案为:分液;
(5)1mol甲烷完全与氯气发生取代反应,若生成相同物质的量的四种取代物,所以每种取代物的物质的量是0.25mol,甲烷和氯气的取代反应中,被取代的氢原子的物质的量与氯气的物质的量相等,所以生成0.25mol一氯甲烷需要氯气0.25mol氯气,生成0.25mol二氯甲烷需要氯气0.5mol,生成0.25mol三氯甲烷需要氯气0.75mol氯气,生成0.25mol四氯化碳需要氯气1mol,所以总共消耗氯气的物质的量=0.25mol+0.5mol+0.75mol+1mol=2.5mol,故答案为:2.5mol.
点评 本题考查氯气的制备以及甲烷与氯气的取代反应,题目难度中等,本题注意实验的原理,以及甲烷的取代反应中被取代的氢原子和氯气之间的关系.

| A. | 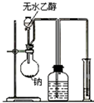 测量钠与乙醇反应生成H2的体积 | B. | 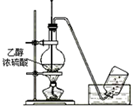 制取乙烯 | ||
| C. | 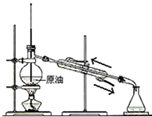 蒸馏石油 | D. | 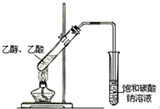 制取乙酸乙酯 |
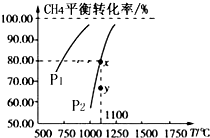 在一恒容的密闭容器中充入0.1mol/L CO2、0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡转化率与温度、压强关系如图,下列有关说法不正确的是( )
在一恒容的密闭容器中充入0.1mol/L CO2、0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡转化率与温度、压强关系如图,下列有关说法不正确的是( )| A. | 此条件下,1molCH4(g)和1molCO2(g)的总能量大于2mol CO(g)和2molH2(g)的总能量 | |
| B. | 压强:P2>P1 | |
| C. | 1100℃达平衡时,c(CO)=0.16 mol/L | |
| D. | 压强为P2时,在y点:v正>v逆 |
( )
| A. | 2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑ | B. | Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | MgCl2(水溶液)$\frac{\underline{\;电解\;}}{\;}$ Mg+Cl2↑ |
| A. | 将红热的铜丝迅速插入乙醇中,可观察到铜丝表面变红,并能闻到刺激性气味 | |
| B. | 乙醇(CH3CH2OH)与二甲醚(CH3-O-CH3)互为同分异构体 | |
| C. | 在蛋白质溶液中加入饱和硫酸铵溶液,会使蛋白质发生变性 | |
| D. | 煤的干馏是化学变化 |
| A. | 电解时,石墨作阴极,不锈钢作阳极 | |
| B. | 电解时,阳极反应是:I--6e-+3H2O═IO3-+6H+ | |
| C. | 溶液调节至强酸性,对生产不利 | |
| D. | 电解后阴极周围溶液的pH升高 |
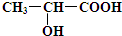
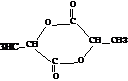 、
、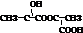 ;
; 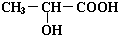 +2Na→
+2Na→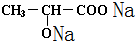 +H2↑;
+H2↑;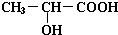 +Na2CO3=2
+Na2CO3=2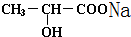 +CO2↑+H2O.
+CO2↑+H2O.

 .
.