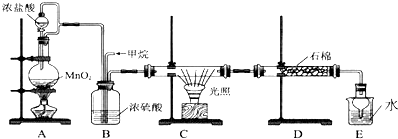
题目内容
9.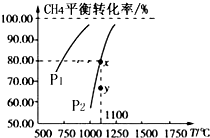 在一恒容的密闭容器中充入0.1mol/L CO2、0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡转化率与温度、压强关系如图,下列有关说法不正确的是( )
在一恒容的密闭容器中充入0.1mol/L CO2、0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡转化率与温度、压强关系如图,下列有关说法不正确的是( )| A. | 此条件下,1molCH4(g)和1molCO2(g)的总能量大于2mol CO(g)和2molH2(g)的总能量 | |
| B. | 压强:P2>P1 | |
| C. | 1100℃达平衡时,c(CO)=0.16 mol/L | |
| D. | 压强为P2时,在y点:v正>v逆 |
分析 A.由图可知,压强一定时,温度越高甲烷的转化率越大,升高温度平衡向正反应进行,据此判断;
B.由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>,据此结合方程式判断压强对平衡移动的影响进行解答;
C.由图可知,压强为P2、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,据此计算甲烷的浓度变化量,利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算该温度下的平衡常数;
D.由图可知,压强为P2、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,Y点甲烷的转化率小于80%,反应向正反应进行,据此判断.
解答 解:A.由图可知,压强一定时,温度越高甲烷的转化率越大,升高温度平衡向正反应进行,故正反应为吸热反应,1molCH4(g)和1molCO2(g)的总能量小于2mol CO(g)和2molH2(g),故A错误;
B.由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>,该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P2>P1,故B正确;
C.由图可知,压强为P2、1100℃的条件下,达到平衡X点时甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,则:
CH4(g)+CO2(g)=2CO(g)+2H2(g),
开始(mol/L):0.1 0.1 0 0
变化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故该温度下c(CO)=0.16 mol/L,故C正确;
D.由图可知,压强为P2、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,Y点甲烷的转化率小于80%,反应向正反应进行,故在Y点:v(正)>v(逆),故D正确;
故选A.
点评 本题考查化学平衡图象、影响化学平衡的因素、化学平衡常数等,难度中等,注意利用“定一议二”原则分析解答.

| A. | 乙酸乙酯和水 酒精和水 | B. | 汽油和水 苯和水 | ||
| C. | 菜籽油和水 甲酸和水 | D. | 苯和水 乙酸和乙醇 |
| A. | 标准状况下,11.2L的CHCl3所含的分子数为0.5NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 9.2g甲苯和丙三醇的混合物中,含氢原子数目为0.8NA | |
| D. | 现有乙烯、丙烯的混合气体共28g,其中碳原子数为2NA |
Ⅰ.制备溴苯
(1)装置中长导管a的作用是冷凝回流、导出气体.
(2)本实验所获得的溴苯为褐色,是因为溴苯溶解了过量的溴.
Ⅱ.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃.同学们设计了如图2流程:
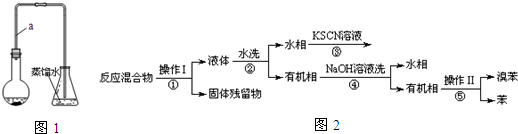
(3)操作Ⅱ为蒸馏.
(4)流程②和④中,需要用到的玻璃仪器是烧杯、分液漏斗;流程③的现象为溶液变血红色(或红色),流程④的作用是除去溴苯中的溴.
Ⅲ.探究原理
(5)反应结束后,某同学取少量锥形瓶中的液体于试管中,再滴入几滴AgNO3溶液,出现浅黄色浑浊,从而判断反应一定生成了HBr.你认为该同学的判断不合理(填“合理”、“不合理”).
(6)为探究锥形瓶中溶液的离子,请完成如表探究实验方案(限选试剂:镁粉、四氯化碳、氯水、溴水、蒸馏水)
| 实验步骤 | 预期现象 | 结论 |
| 1.将锥形瓶中的液体转入分液漏斗,加足量①四氯化碳,振荡后分液.分别取少量②上层溶液于试管A、B中 | ||
| 2.向试管A中加入少量③和四氯化碳,振荡后静置; | 溶液分层,下层显④红棕(橙红色也可以)色 | 锥形瓶中液体含大量Br- |
| 3.向试管B中加入⑤镁粉. | 有汽泡生成 | 锥形瓶中液体含大量⑥H+ |
 .
. | A. | vA=0.5 mol•L-1•s-1 | B. | v B=0.5 mol•L-1•s-1 | ||
| C. | vC=0.4 mol•L-1•s-1 | D. | vD=1.2 mol•L-1•min-1 |
| 事实 | 结论 |
| A.甲乙两种物质,相对分子质量相同,结构不同 | 甲和乙一定是同分异构体 |
| B.灼烧棉织品、羊毛衫和涤纶衣物 | 有烧焦羽毛气味的是羊毛衫 |
| C.在淀粉溶液中加入市售的加碘食盐不出现蓝色 | 不能说明此盐不含碘元素 |
| D.完全燃烧产物是CO2和H2O的物质 | 一定只含C、H元素 |
| A. | A | B. | B | C. | C | D. | D |
| A. | C3H7Cl | B. | C3H6 | C. | CH2Cl2 | D. | C4H10 |
| A. | 油脂的水解反应又叫做皂化反应 | |
| B. | 一定条件下,糖类都能发生水解反应 | |
| C. | 蛋白质发生变性后,直接生成氨基酸 | |
| D. | 通过灼烧时产生的气味可以鉴别蚕丝和棉纱 |