题目内容
13.A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料.它们的结构简式如下:
请回答下列问题:
(1)写出B中官能团的名称:碳碳双键、(酚)羟基.
(2)能发生银镜反应的有AC(填序号).
(3)满足下列条件的D的同分异构体有3种.
①遇FeCl3溶液显紫色 ②能发生水解反应 ③苯环上的一氯代物有两种
(4)按图,C经一步反应可生成E,E是B的同分异构体,则反应①的反应类型是氧化反应,写出F的结构简式
 .
.
分析 (1)由B的结构简式可知,含有官能团有羟基、碳碳双键;酚羟基邻位、对位有H原子,能与溴发生取代反应,碳碳双键能与溴发生加成反应;
(2)含有醛基-CHO的物质能发生银镜反应;
(3)根据D的结构简式,结合题中限制条件及同分异构体的书写原则进行判断;
(4)C经一步反应可生成E,E是B的同分异构体,则反应①为氧化反应,E为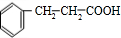 ,反应②为酯化反应,由相对分子质量,可知该反应中醇为CH3CH2OH.
,反应②为酯化反应,由相对分子质量,可知该反应中醇为CH3CH2OH.
解答 解:(1)由B的结构简式可知,含有的官能团为碳碳双键、(酚)羟基,
故答案为:碳碳双键、(酚)羟基;
(2)含有醛基-CHO的物质能发生银镜反应,A、C中含有醛基,可发生银镜反应,
故答案为:AC;
(3)D的同分异构体中,①遇FeCl3溶液显紫色,说明分子中含有酚羟基,则有机物中含有苯环和酚羟基; ②能发生水解反应,则其分子中应该含有酯基;③苯环上的一氯代物有两种,则苯环上的取代基具有对称结构,则满足条件的有机物分子中在苯环的对位上含有:①-OH和-OOCCH3、②-OH、-CH2OOCH、③-OH、-COOCH3,所以满足条件的有机物总共有3种,
故答案为:3;
(4)C经一步反应可生成E,E是B的同分异构体,则反应①为氧化反应,E为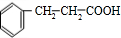 ,反应②为酯化反应,由相对分子质量,可知该反应中醇为CH3CH2OH,则F的结构简式为
,反应②为酯化反应,由相对分子质量,可知该反应中醇为CH3CH2OH,则F的结构简式为 ,
,
故答案为:氧化反应; .
.
点评 本题考查有机物的合成,题目难度中等,涉及有机物的合成、官能团结构和性质、同分异构体书写等知识,是对有机基础的综合考查,需要学生熟练掌握官能团与性质与转化.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.对反应3A(g)+B(g)═2C(g)+2D(g),下列表示的速率最快的是( )
| A. | vA=0.5 mol•L-1•s-1 | B. | v B=0.5 mol•L-1•s-1 | ||
| C. | vC=0.4 mol•L-1•s-1 | D. | vD=1.2 mol•L-1•min-1 |
8.下列说法正确的是( )
| A. | 乙烯的结构简式可表示为CH2CH2 | |
| B. | 苯、乙醇、乙酸都能发生取代反应 | |
| C. | 甲烷可以与氯气反应,而乙烯不能与氯气反应 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |
18.下列分子只表示一种物质的是( )
| A. | C3H7Cl | B. | C3H6 | C. | CH2Cl2 | D. | C4H10 |
2.I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示.
其中Y所处的周期序数与族序数相等.按要求回答下列问题:
(1)写出X的原子结构示意图 .
.
(2)列举一个事实说明W非金属性强于Z:2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(用化学方程式表示)
II.运用所学化学原理,解决下列问题:
(3)已知:Si+2NaOH+H2O═Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si-4e-+6OH-=SiO32-+3H2O;
(4)已知:①C(s)+O2(g)═CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s)△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1;
(5)已知:CO(g)+H2O(g) $?_{△}^{催化剂}$ H2(g)+CO2(g).右表为该反应在不同温度时的平衡常数.
则:该反应的△H<0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为75%.
| X | ||||
| Y | Z | W |
(1)写出X的原子结构示意图
 .
.(2)列举一个事实说明W非金属性强于Z:2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(用化学方程式表示)
II.运用所学化学原理,解决下列问题:
(3)已知:Si+2NaOH+H2O═Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si-4e-+6OH-=SiO32-+3H2O;
(4)已知:①C(s)+O2(g)═CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s)△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1;
(5)已知:CO(g)+H2O(g) $?_{△}^{催化剂}$ H2(g)+CO2(g).右表为该反应在不同温度时的平衡常数.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
3.将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体(NOx)的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
| A. | 0.05mol | B. | 0.13mol | C. | 1.05mol | D. | 1mol |
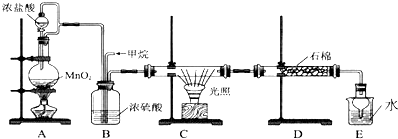
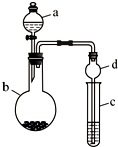 某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验.请根据下列实验回答问题:
某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验.请根据下列实验回答问题: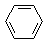 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$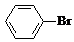 +HBr.向c中滴加AgNO3溶液,可观察到的现象是产生浅黄色沉淀.
+HBr.向c中滴加AgNO3溶液,可观察到的现象是产生浅黄色沉淀.