题目内容
6.过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一.试回答下列问题:(1)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是ACD.
A.苯与B3N3H6互为等电子体,且分子中原子共平面
B.甲醛、苯和二氧化碳中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
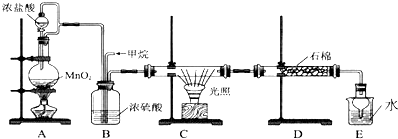
(2)二茂铁又叫双环戊二烯基铁[化学式:Fe(C5H5)2],结构如1图所示,是一种具有芳香族性质的有机金属化合物.外观为橙色,熔点为172℃,沸点249℃,100℃以上能升华;不溶于水,溶于甲醇、乙醇等有机溶剂中.其中Fe2+离子与两个环戊二烯基是依靠配位键连接.二茂铁[Fe(C5H5)2]属于分子晶体.
(3)锰类金属添加剂不仅可有效提高辛烷值,而且可大大减少汽车尾气中CO、NOx、C2H4等物质排放,再经催化转化为CO2、N2等.
①CMT是一种锰类金属添加剂,其结构如图3.结合上一问,C5H5Mn(CO)3中锰的价态是+1.
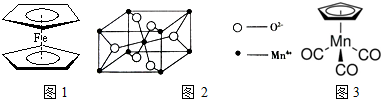
②锰的氧化物可与镧的氧化物合成汽车尾气净化催化剂.某锰的氧化物晶胞结构如图2所示,1个晶胞中Mn4+数目为2.
(4)铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,Cu失去一个电子成为Cu+后,核外电子排布为[Ar]3d10,属于能量较低的稳定结构,所以Cu第二电离能相对较大.
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
分析 (1)A.价电子总数相等、原子数也相等微粒互为等电子体,等电子体结构相似;
B.甲醛、苯分子中碳原子均形成3个σ键,二氧化碳中碳原子均形成2个σ键,均没有孤电子对;
C.分子中正负电荷重心重合的为非极性分子,正负电荷重心不重合的为极性分子;
D.水分子之间形成氢键,沸点较高;
(2)二茂铁熔沸点低,能升华,易溶于有机溶剂,应属于分子晶体;
(3)①CO与Mn之间形成配位键,环戊二烯的分子式为C5H6,去掉一个H原子形成C5H5-,根据化合价规则可以判断Mn元素化合价;
②根据均摊法计算晶胞中Mn4+数目;
(4)轨道中电子处于全满、全空、半满时较稳定.
解答 解:(1)A.苯与B3N3H6价电子总数相等,原子数也相等互为等电子体,苯与B3N3H6均为平面结构,分子中原子共平面,故A正确;
B.甲醛、苯分子中碳原子均形成3个σ键,二氧化碳中碳原子均形成2个σ键,均没有孤电子对,甲醛、苯分子中碳原子采用sp2杂化,二氧化碳分子中C原子采取sp杂化,故B错误;
C.苯、二氧化碳分子的空间结构对称是非极性分子,甲醛分子的空间结构不对称属于极性分子,故C正确;
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键,故D正确;
故选:ACD;
(2)二茂铁熔沸点低,能升华,易溶于有机溶剂,应属于分子晶体,故答案为:分子;
(3)①CO与Mn之间形成配位键,环戊二烯的分子式为C5H6,去掉一个H原子形成C5H5-,根据化合价规则,可知Mn元素化合价为+1,故答案为:+1;
②晶胞中Mn4+数目数目为1+8×$\frac{1}{8}$=2,故答案为:2;
(4)轨道中电子处于全满、全空、半满时较稳定,所以气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小),
故答案为:Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,Cu失去一个电子成为Cu+后,核外电子排布为[Ar]3d10,属于能量较低的稳定结构,所以Cu第二电离能相对较大.
点评 本题是对物质结构的考查,涉及等电子体、杂化方式、分子构型、分子极性、氢键、晶体类型与性质、配合物、晶胞计算、电离能等,是对学生综合能力的考查,难度中等.

| A. | 乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去 | |
| B. | 乙醇能溶解很多有机物和无机物,可用乙醇提取中药中的有效成分 | |
| C. | 乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒 | |
| D. | 乙醇容易挥发,所以才有“酒香不怕巷子深”的俗语 |
Ⅰ.制备溴苯
(1)装置中长导管a的作用是冷凝回流、导出气体.
(2)本实验所获得的溴苯为褐色,是因为溴苯溶解了过量的溴.
Ⅱ.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃.同学们设计了如图2流程:
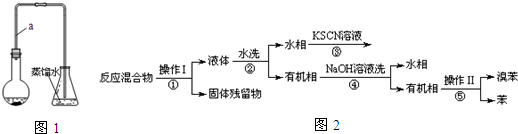
(3)操作Ⅱ为蒸馏.
(4)流程②和④中,需要用到的玻璃仪器是烧杯、分液漏斗;流程③的现象为溶液变血红色(或红色),流程④的作用是除去溴苯中的溴.
Ⅲ.探究原理
(5)反应结束后,某同学取少量锥形瓶中的液体于试管中,再滴入几滴AgNO3溶液,出现浅黄色浑浊,从而判断反应一定生成了HBr.你认为该同学的判断不合理(填“合理”、“不合理”).
(6)为探究锥形瓶中溶液的离子,请完成如表探究实验方案(限选试剂:镁粉、四氯化碳、氯水、溴水、蒸馏水)
| 实验步骤 | 预期现象 | 结论 |
| 1.将锥形瓶中的液体转入分液漏斗,加足量①四氯化碳,振荡后分液.分别取少量②上层溶液于试管A、B中 | ||
| 2.向试管A中加入少量③和四氯化碳,振荡后静置; | 溶液分层,下层显④红棕(橙红色也可以)色 | 锥形瓶中液体含大量Br- |
| 3.向试管B中加入⑤镁粉. | 有汽泡生成 | 锥形瓶中液体含大量⑥H+ |
 .
. | 事实 | 结论 |
| A.甲乙两种物质,相对分子质量相同,结构不同 | 甲和乙一定是同分异构体 |
| B.灼烧棉织品、羊毛衫和涤纶衣物 | 有烧焦羽毛气味的是羊毛衫 |
| C.在淀粉溶液中加入市售的加碘食盐不出现蓝色 | 不能说明此盐不含碘元素 |
| D.完全燃烧产物是CO2和H2O的物质 | 一定只含C、H元素 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  用氯化铵和氢氧化钠固体制NH3 | B. | 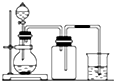 用铜片和稀硝酸制NO | ||
| C. | 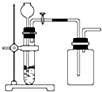 用锌粒和稀硫酸制H2 | D. | 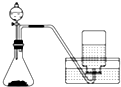 用H2O2和MnO2制O2 |
| A. | C3H7Cl | B. | C3H6 | C. | CH2Cl2 | D. | C4H10 |
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯与浓硝酸和浓硫酸的混合液反应生成油状液体 | |
| D. | 乙烯与溴的四氯化碳溶液反应 |