题目内容
【题目】己知:①pOH=-lgc(OH-);②N2H4 +H2O![]() N2H5++OH-、N2H5++H2O
N2H5++OH-、N2H5++H2O![]() N2H62++OH-,分别对应有pOH1和pOH2。常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH随离子浓度变化的关系如图所示。下列叙述错误的是
N2H62++OH-,分别对应有pOH1和pOH2。常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH随离子浓度变化的关系如图所示。下列叙述错误的是
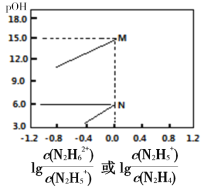
A.曲线M表示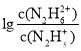 变化关系
变化关系
B.N2H4与硫酸形成的酸式盐的化学式为N2H5HSO4
C.pOH1>pOH2
D.反应N2H5+ + H2O ![]() N2H62+ + OH-的K=10-15
N2H62+ + OH-的K=10-15
【答案】BC
【解析】
M、N点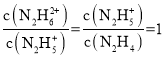 ,M点c(OH-)=10-15、N点c(OH-)=10-6,M点表示的电离平衡常数=10-15,N点表示的电离平衡常数=10-6;第一步电离常数大于第二步电离常数。
,M点c(OH-)=10-15、N点c(OH-)=10-6,M点表示的电离平衡常数=10-15,N点表示的电离平衡常数=10-6;第一步电离常数大于第二步电离常数。
A.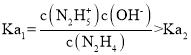 ,所以曲线M表示pOH与
,所以曲线M表示pOH与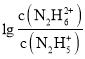 的变化关系,曲线N表示pOH与
的变化关系,曲线N表示pOH与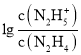 的变化关系,故A正确;
的变化关系,故A正确;
B.根据电离方程式可知,N2H4为二元碱,可以结合两个H+,与硫酸形成的酸式盐的化学式为N2H6(HSO4)2,故B错误;
C.推导可知pOH1=-lgKa1、pOH2=-lgKa2,Ka1>Ka2,所以pOH1<pOH2,故C错误;
D. 反应N2H5+ + H2O![]() N2H62+ + OH-为第二步反应,M点时
N2H62+ + OH-为第二步反应,M点时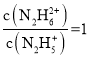 ,c(OH-)=10-15, K=
,c(OH-)=10-15, K=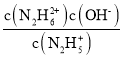 =10-15,故D正确;
=10-15,故D正确;
答案选BC。

【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀