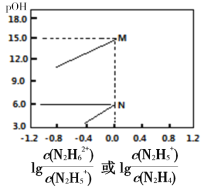
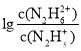题目内容
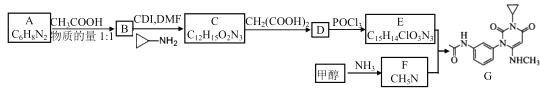
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]是一种杀虫剂,它可以通过以下步骤制备。
步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成 CuCl2。已知 Fe3+对该反应有催化作用,其催化原理如图所示。
步骤 2:在制得的 CuCl2 溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。
下列有关说法正确的是
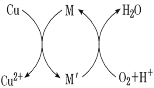
A.a、b、c之间的关系式为:a=b+c
B.图中 M、Mˊ分别为 Fe2+、Fe3+
C.步骤 1 充分反应后,加入少量 CuO 是为了除Fe3+
D.若制备 1 mol CuCl2,理论上消耗 11.2 L O2
【答案】C
【解析】
A.化合物中正负化合价的代数和等于0,可知:2a=b+c,故A错误;
B.由催化原理示意图可知Mˊ先与氧气和氢离子反应生成M和水,然后M和铜反应生成铜离子和Mˊ,因此M、Mˊ分别是Fe3+、Fe2+,故B错误;
C.Fe3+水解使溶液显酸性,CuO与H+反应产生Cu2+和水,当溶液的pH增大到一定程度,Fe3+形成Fe(OH)3沉淀而除去,从而达到除去Fe3+的目的,故C正确;
D.制备1mol的CuCl2,转移2mol电子,根据电子守恒,需要消耗0.5molO2,由于不清楚氧气所处的条件,所以不能确定气体的体积,故D错误;
答案选C。

 全程金卷系列答案
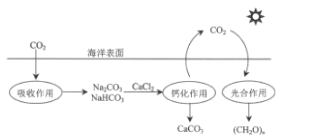
全程金卷系列答案【题目】减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g)CH2O(g)+H2O(g) H。请回答下列问题:
(1)己知:
①CH2O(g)+O2(g)=CO2(g)+H2O(g) H1=-480kJ/mol
②相关化学键的键能数据如表所示:
化学键 | O=O | H-H | O-H |
键能/kJmol-1 | 498 | 436 | 464 |
则CO2(g)+2H2(g)CH2O(g)+H2O(g) H=____________
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)CH2O(g)+H2O(g)。
①下列说明反应已经达到平衡状态的是____(填选项字母)。
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是_____填选项字母)
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2L密闭容器中进行模拟上述合成CH2O的实验。T1℃时,将体积比为1:4的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
①已知:vp(B)=![]() 则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPamin-1。
则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPamin-1。
②T1℃时,反应的平衡常数Kp的代数式为Kp=_______kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数)。
(4)T2℃时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2 kPa,反应达到平衡时,CH2O的分压与起始的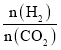 关系如图所示:
关系如图所示:
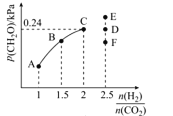
①当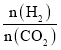 =2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
=2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
②当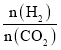 =2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______
=2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______