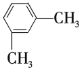
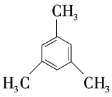
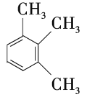
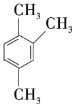
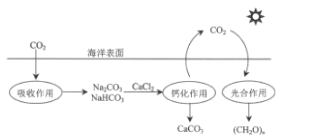
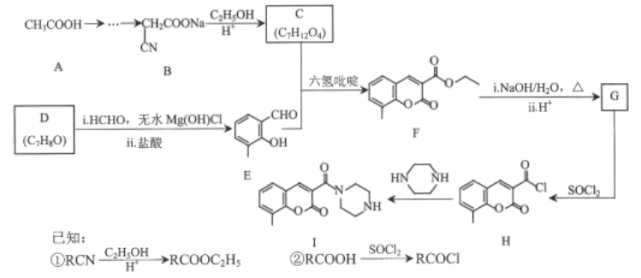
题目内容
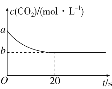
【题目】钠离子电池相比锂离子电池具有高安全、长寿命、低成本的特点,有望成为下一代电池。某钠离子电池放电时的总反应为Na(1-x)MO2+NaxCn═NaMO2+nC,如图表示其充电过程。有关该电池的说法错误的是( )
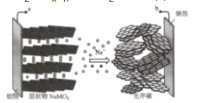
A.充电时,a与外加电源正极相连
B.放电时,外电路电子由b流向a
C.充电时,无序碳上发生的反应为nC+xNa++xe-═NaxCn
D.用该电池电解精炼铜,当电池中迁移1molNa+时,理论上可获得64g纯铜
【答案】D
【解析】
根据题意,该装置为电解池装置,根据电解池的工作原理,以及Na+移动的方向,推出b电极为阴极,a电极为阳极,对电池充电时,电池的正极接电源的正极,电池的负极接电源的负极,据此分析;
A. 根据图示,Na+从左向右移动,根据电解池工作原理,阳离子向阴极区移动,即电极b为阴极,电极a为阳极,电极a与外加电源正极相连,故A说法正确;
B. 充电时,电池的正极接电源的正极,电池的负极接电源的负极,推出放电时电极a为正极,电极b为负极,外电路电子由b流向a,故B说法正确;
C. 根据放电的总反应,推出充电时,无序碳上发生的反应式为nC+xNa++xe-=NaxCn,故C说法正确;
D. 精炼铜时,阴极反应式为Cu2++2e-=Cu,当电池中迁移1molNa+,说明电路中通过1mole-,即获得纯铜的质量为![]() =32g,故D说法错误;
=32g,故D说法错误;
答案:D。

【题目】有U、V、W、X、Y、Z六种前四周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息比 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
W | 基态时, 2p 轨道处于半充满状态 |
X | 自然界中含量最多 |
Y | 是第四周期元素中未成对电子数最多的元素 |
请回答下列问题:
(1)W、X、V第一电离能由大到小顺序:________________________(用元素符号表示)
(2)V的最高价氧化物对应含氧酸中,酸根的立体构型为:_________,中心原子的杂化方式为:_______________;
(3)Y的基态原子的价电子排布图为____________________________;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子。两者沸点的关系为乙______丙(填“>”或“<”),原因是__________________________________________;
(5)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中属于____________晶体