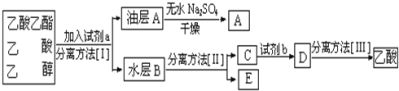
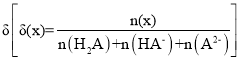题目内容
【题目】甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
I.用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l) △H= -37.3 kJ/mol,则CO2(g)+3H2(g)=CH3OH(g)+ H2O(1) △H=____kJ/mol。
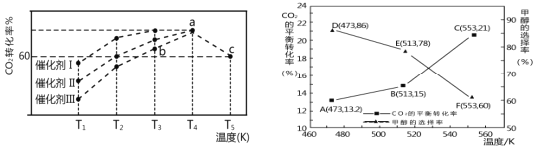
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应[生成 H2O(g)],如图1表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系。
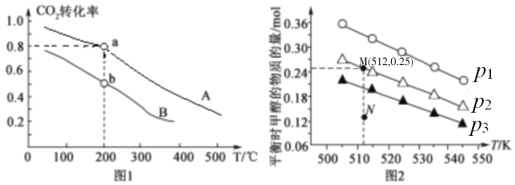
①a、b两点化学反应速率分别用Va、Vb,表示,则Va ___Vb(填“大于”、“小于”或“等于”)。
②列出a点对应的平衡常数表达式K= ____________________。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g) ![]() CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512 K时,图中N点υ(正)<υ(逆)
(4)CO2催化加氢合成乙醇的反应为:2CO2(g)+6H2(g) ![]() C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=
C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=![]()
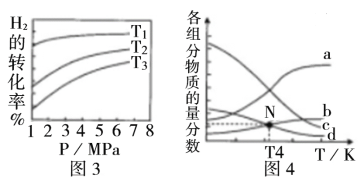
①图3中投料比相同,温度T3>T2>T1,则该反应的焓变△H____0(填“>”、“<”)。
②m=3时,该反应达到平衡状态后p(总)=20a MPa,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=___________。
Ⅱ.甲醇的应用
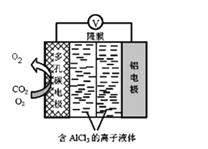
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。
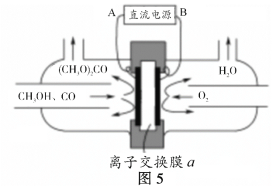
离子交换膜a为_____(填“阳膜”、“阴膜”),阳极的电极反应式为______________。
【答案】-94.3 大于 K=![]() AC < CO2 2.5a MPa 阳膜 2CH3OH+CO2e=(CH3O)2CO+2H+
AC < CO2 2.5a MPa 阳膜 2CH3OH+CO2e=(CH3O)2CO+2H+
【解析】
(1)①H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJ/mol,
O2(g)=H2O(l)△H=-285.8kJ/mol,
②CH3OH(g)=CH3OH(l)△H= -37.3kJ/mol,
③CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,
由盖斯定律①×3-③-②;可得CO2(g)+3H2(g)=CH3OH(g)+H2O(1)△H=-94.3kJ/mol;
(2)①a、b两点温度相同,正反应为气体体积减小的反应,增大压强平衡正向移动,二氧化碳转化率增大,故压强曲线A大于曲线B,压强越大反应速率越快,故反应速率Va大于Vb;
②a点发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),平衡常数表达式K=![]() ;
;
(3)A.由图可知,随着温度升高,平衡时甲醇的物质的量在减小,所以升温平衡向逆反应方向移动,则正反应为放热反应,故A正确;
B.由图可知,作一条等温线,因为该反应为气体体积减小的反应,压强越大,平衡时甲醇的物质的量也越大,所以p1>p2>p3,故B错误;
C.由图可知,M点对应的甲醇产量为0.25mol,则

所以K=![]() =1.04×102;故C正确;
=1.04×102;故C正确;
D.由图可知,在p2及512K时,N点甲醇的物质的量还小于平衡时的量,所以应该正向移动,则v(正)>v(逆),故D错误;
答案选AC;
(4)①由图3可知,相同压强下,温度越高氢气转化率越小,说明升高温度反应向逆向移动,正反应放热,△H<0;
②温度升高,反应逆向进行,所以产物的物质的量是逐渐减少的,反应物的物质的量增大,由图可知,根据反应计量系数关系,曲线a代表的物质为H2,b表示CO2,c为H2O,d为C2H5OH;设开始氢气的投入量是3nmol,则二氧化碳是nmol,二氧化碳的转化量是x,
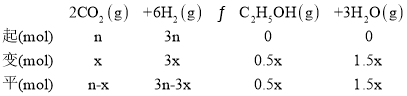
N点b、d的物质的量分数相同,所以n-x=0.5x,解得x=![]() n,总物质的量是n-x+3n-3x+0.5x+1.5x=
n,总物质的量是n-x+3n-3x+0.5x+1.5x=![]() n,压强之比等于物质的量之比,组分平衡分压=总压×该组分的物质的量分数,d为C2H5OH,达到平衡时乙醇的压p(乙醇)=
n,压强之比等于物质的量之比,组分平衡分压=总压×该组分的物质的量分数,d为C2H5OH,达到平衡时乙醇的压p(乙醇)=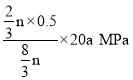 =2.5a MPa;
=2.5a MPa;
(5)由图分析可知氧气得电子,发生还原反应,与氢离子结合生成水,该电极为阴极,则氢离子要透过交换膜a在阴极与氧气结合,则交换膜a为阳离子交换膜;阳极上是甲醇和一氧化碳反应失电子发生氧化反应,电极反应为:2CH3OH+CO-2e=(CH3O)2CO+2H+。

 阅读快车系列答案
阅读快车系列答案