题目内容
3.将0.390g锌粉加入到20.0mL 0.200mol.L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )| A. | M | B. | M2+ | C. | M3+ | D. | MO2+ |
分析 恰好完全反应时,Zn失去电子数等于M得到电子数,结合电子守恒计算.
解答 解:设还原产物中M元素的化合价为x,
由电子守恒可知,
$\frac{0.390g}{65g/mol}$×(2-0)=0.02L×0.200mol/L×(5-x),
解得x=2,
即还原产物为M2+,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握氧化还原反应中氧化剂和还原剂之间得失电子数目相等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
13.矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金-氰化法提炼,及采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸取如溶液中,然后用金属锌作还原剂将金从溶液中置换析出,其反应原理为:
①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[An(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[An(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
| A. | Na[Au(CN)2]可溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+2 | |
| C. | 金化学性质稳定,不与任何物质反应 | |
| D. | 在提炼过程中含金元素的物质始终作氧化剂 |
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 80g CuO和Cu2S的混合物含有铜原子数一定为NA | |
| B. | 电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 | |
| C. | 1mol铁与1molCl2充分反应,转移电子数为3NA | |
| D. | 向含有FeI2的溶液中通入适量氯气,当有1mol Fe2+被氧化时该反应转移电子的数目至少为NA |
11.下表为元素周期表短周期的一部分,下列有关X、Y、Z、W四种元素的叙述正确的是( )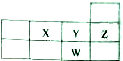

| A. | 原子半径大小:W>Y>X | B. | 核电荷数:W>Z>Y>X | ||
| C. | W的氧化物对应的水化物为强酸 | D. | X是ⅥA族元素,其最高化合价为+6价 |
18.化学与生活联系紧密,下列说法正确的是( )
| A. | 食品包装袋中常用生石灰做食品的防腐剂 | |
| B. | 硫酸钙溶液不能使豆浆中的蛋白质发生聚沉而制取豆腐 | |
| C. | 金属钠着火可用碳酸氢钠干粉灭火器灭火 | |
| D. | “84消毒液”具有强氧化性,可以杀死流感病毒 |
8.某课外活动小组使用下图装置利用浓盐酸制取氯气并制备一定量的FeCl3,下列说法错误的是( )

| A. | 装置a烧瓶内加入的固体可以是MnO2 | |
| B. | 若按a、e、d、b、c顺序连接装置,则e中盛装的是浓硫酸 | |
| C. | 制备过程中装置b硬质玻璃管内有红棕色的烟产生 | |
| D. | 验证产物中的Fe3+存在可使用KSCN溶液 |
15.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比溴化氢的沸点高 | |
| D. | Li、Na、K单质的熔点逐渐升高 |
12.下列离子在溶液中可以大量共存的一组是( )
| A. | Na+ NO3- SO42- | B. | Ag+ NO3- Cl- | ||
| C. | K+ H+ HCO3- | D. | NH4+ Na+ OH- |
13.类比推理的方法是化学学习与研究中有广泛的应用,但有时会得出错误的结论,以下几种类比推理结论中正确的是( )
| A. | H2SO4为强酸,推出HClO4为强酸 | |
| B. | Fe3Cl8可以改写为FeCl2 •2FeCl3,推出Fe3I8可以改写为FeI2 •2FeI3 | |
| C. | NH3的沸点高于PH3,推出CH4沸点高于SiH4 | |
| D. | CO2 通入Ba(NO3)2 溶液中无沉淀生成,推出SO2通入Ba(NO3)2 溶液中无沉淀生成 |