题目内容
11.下表为元素周期表短周期的一部分,下列有关X、Y、Z、W四种元素的叙述正确的是( )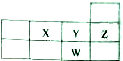
| A. | 原子半径大小:W>Y>X | B. | 核电荷数:W>Z>Y>X | ||
| C. | W的氧化物对应的水化物为强酸 | D. | X是ⅥA族元素,其最高化合价为+6价 |
分析 由五种元素在周期表中的位置可知,X为O元素,Y为F元素,W为Cl元素,Z为Ne元素.
A.同周期自左而右原子半径进行,电子层越多原子半径越大;
B.同周期自左而右核电荷数增大,电子层越多核电荷数越大;
C.W的氧化物对应的水化物不一定为强酸,如HClO属于弱酸;
D.氧元素没有最高价+6.
解答 解:由五种元素在周期表中的位置可知,X为O元素,Y为F元素,W为Cl元素,Z为Ne元素.
A.同周期自左而右原子半径进行,电子层越多原子半径越大,故原子半径:W>X>Y,故A错误;
B.同周期自左而右核电荷数增大,电子层越多核电荷数越大,故核电荷数:W>Z>Y>X,故B正确;
C.W的氧化物对应的水化物不一定为强酸,如HClO属于弱酸,故C错误;
D.X是氧元素,属于ⅥA族元素,但氧元素没有最高价+6,故D错误,
故选B.
点评 本题考查元素周期表与元素周期律,难度不大,注意周期表中元素化合价的特殊性.

练习册系列答案
相关题目
1.向淀粉溶液中加少量稀H2SO4,加热,使淀粉水解,为测定其是否完全水解,需要加入的试剂是( )
| A. | NaOH溶液 | B. | 新制的Cu(OH)2悬浊液 | ||
| C. | 碘水 | D. | 溴水 |
19.常言“真金不怕火炼”从化学的角度对这句话的理解正确的是( )
| A. | 金在高温下发生了钝化 | B. | 金越炼硬度越大 | ||
| C. | 金的化学性质稳定,不易变质 | D. | 金的硬度大,高温下难于变形 |
6.对于反应:S(s)+O2(g)?SO2(g),可使反应速率增大的措施是( )
①增大压强②升高温度③通入O2④增加硫的量⑤降低压强.
①增大压强②升高温度③通入O2④增加硫的量⑤降低压强.
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ②③④⑤ |
3.将0.390g锌粉加入到20.0mL 0.200mol.L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
| A. | M | B. | M2+ | C. | M3+ | D. | MO2+ |
20.下列叙述正确的是( )
| A. | 离子晶体中一定含有离子键 | |
| B. | 分子晶体中一定含有共价键 | |
| C. | 氧化钠和过氧化钠中含有的化学键种类相同 | |
| D. | 通常情况下水分子较稳定,是因为水分子间存在氢键 |
 CH2=CHCOOCH2CH3+H2O,该反应的类型是取代反应;
CH2=CHCOOCH2CH3+H2O,该反应的类型是取代反应; ;
;