题目内容
向100mL18mol/L的硫酸中加入足量铜片,加热并充分反应。下列有关说法正确的是
| A.充分反应后转移1.8mol电子 | B.H2SO4只作氧化剂 |
| C.若不加热应生成H2 | D.消耗的铜的质量一定少于57.6g |
D
解析试题分析: 铜与浓硫酸反应生成硫酸铜、二氧化硫和水,随着反应进行,硫酸浓度变稀,铜与稀硫酸不反应。A、硫酸不可能完全反应,转移电子数小于1.8mol,错误;B、硫酸表现氧化性和酸性,错误;C、铜与浓硫酸常温下不反应,错误;D、由Cu~2H2SO4知消耗铜的物质的量小于0.9mol,正确。
考点: 元素及其化合物

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| B | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有CO32-或HCO3- |
| C | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| D | 取久置的绿矾(FeSO4·7H2O)溶于水,加入KSCN溶液 | 溶液变为血红色 | 绿矾部分或全部被氧化 |
下列有关说法不正确的是
| A.明矾净化水是因为明矾的水解产物有吸附作用 |
| B.FeCl3溶液腐蚀铜电路板的过程发生了置换反应 |
| C.氨氧化法制硝酸的过程中有NO2生成 |
| D.氯碱工业中,NaOH是在阴极室中产生的 |
下列陈述I、II正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述II |
| A | Fe2(SO4)3可以做净水剂 | Fe 3+水解成胶体可吸附水中的细小悬浮物 |
| B | 向Ba(NO3)2溶液中通入足量SO2,无明显现象 | 弱酸不能制强酸 |
| C | Cl2能使湿润的布条褪色 | Cl2具有漂白性 |
| D | 电解NaCl溶液制备金属钠 | NaCl是离子化合物 |
下列有关化学反应过程的叙述中,错误的是
| A.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| B.除去CO2中的少量SO2:通过盛有饱和NaHCO3溶液的洗气瓶 |
| C.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 |
| D.金属钠在空气中燃烧产生黄色火焰,生成淡黄色固体 |
固体X只可能由A1、(NH4)2SO4 ,MgCl2.FeCl2, AlCl3, AgN03中的一种或几种组成,某同学对该固体进行了如下实验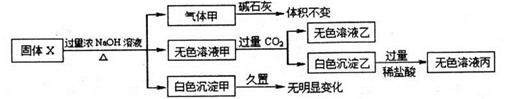
下列判断正确的是:
| A.气体甲一定是纯挣物 |
| B.白色沉淀甲可能是混合物 |
| C.固体X中一定存在AlCl3、(NH4)2SO4, MgCl2 |
| D.固体X中一定不存在FeCl2、AgNO3 |
下列说法正确的是
| A.硅和石墨都是重要的半导体材料 |
| B.SO2、NO2、CO2都会导致酸雨的形成 |
| C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理不同 |
| D.氢能是清洁能源,工业上用电解水法制大量氢气符合节能减排理念 |