题目内容
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:(1)混合物中是否存在FeCl2:____________(填“是”或“否”)。
(2)混合物中是否存在(NH4)2SO4:____________(填“是”或“否”)。
(3)写出反应⑤的离子方程式:________________________。
(4)请根据图中数据分析,原固体混合物的成分为 (写化学式)
(1)否;(2)是;(3)Al(OH)3 + 3H+=Al3+ + 3H2O(4)Al、(NH4)2SO4和MgCl2
解析试题分析:根据题给流程图分析知,28.1g固体在浓氢氧化钠溶液加热的条件下,生成标准状况下11.2L气体(物质的量为0.5mol),气体通过碱石灰体积不变(无酸性气体),通过浓硫酸体积减小,说明剩余的6.72 L气体(物质的量为0.3mol)为氢气,即原固体中一定含有金属Al,根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑计算得,铝的物质的量为0.2mol,质量为5.4 g;生成氨气的物质的量为0.2 mol,则原固体中一定含有 0.1 mol (NH4)2SO4,其质量为13.2 g;得到白色沉淀久置不变色,说明无FeCl2(氢氧化亚铁易被氧化为红棕色的氢氧化铁),因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,则说明5.8 g白色沉淀为Mg(OH)2,为0.1 mol,则固体中MgCl2为0.1 mol,质量为9.5g,无色溶液中有Al与过量NaOH溶液反应后得到的NaAlO2。(1)白色沉淀久置不变色,说明无FeCl2(氢氧化亚铁易被氧化为红棕色的氢氧化铁),答案为:否;(2)气体通过浓硫酸后,体积减少4.48 L,说明气体中有NH3,则原固体中一定含有(NH4)2SO4,(3)反应⑤为氢氧化铝与盐酸反应,方程式为Al(OH)3 + 3H+=Al3+ + 3H2O;(4)由以上分析可知原固体中一定含有金属Al,其质量为5.4 g,一定含有 0.1 mol (NH4)2SO4,其质量为13.2 g,固体中MgCl2为0.1 mol,质量为9.5g,三种物质的质量之和刚好等于28.1g,所以一定没有AlCl3,原固体中一定含有Al、(NH4)2SO4和MgCl2三种物质。
考点:考查物质的分离、提纯以及检验。

向100mL18mol/L的硫酸中加入足量铜片,加热并充分反应。下列有关说法正确的是
| A.充分反应后转移1.8mol电子 | B.H2SO4只作氧化剂 |
| C.若不加热应生成H2 | D.消耗的铜的质量一定少于57.6g |
下列说法正确的是( )
| A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因 |
| B.CH4、NH3、PH3的热稳定性逐渐增强 |
| C.因为酸性:HC1>HF,所以非金属性:Cl>F |
| D.钠原子在反应中失去的电子比铝原子少,故钠的金属性比铝弱 |
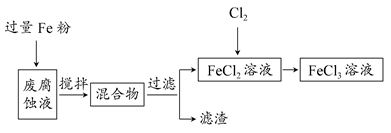

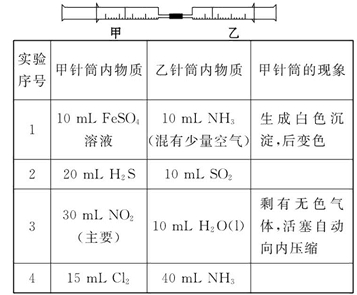
 B(在水溶液中进行)
B(在水溶液中进行) ;请回答下列问题:
;请回答下列问题: