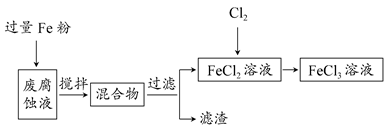
题目内容
下列有关说法不正确的是
| A.明矾净化水是因为明矾的水解产物有吸附作用 |
| B.FeCl3溶液腐蚀铜电路板的过程发生了置换反应 |
| C.氨氧化法制硝酸的过程中有NO2生成 |
| D.氯碱工业中,NaOH是在阴极室中产生的 |
B
解析试题分析:十二水合硫酸铝钾俗称为明矾,属于强酸弱碱盐,所含铝离子能水解生成氢氧化铝胶体,氢氧化铝胶体粒子直径介于1~100nm之间,因而具有很大的表面积、很强的吸附性,因此明矾能净水,故A错误;氯化铁溶液腐蚀铜电路板的原理为:2FeCl3+Cu=2FeCl2+CuCl2,由于生成物都是化合物,则该反应不属于置换反应,故B错误;氨氧化法制硝酸包括如下三个主要反应:氨与氧气反应生成一氧化氮和水、一氧化氮与氧气反应生成二氧化氮、二氧化氮与水反应生成硝酸和一氧化氮,故C正确;用惰性电解饱和食盐水时,溶质和溶剂电离出的阳离子都移向阴极,但钠离子的氧化性比氢离子弱,则阴极反应式为2H++2e¯=H2↑或2H2O+2e¯=H2↑+2OH¯,阴极产生的氢氧根与钠结合为氢氧化钠,故D正确。
考点:考查元素化合物的主要性质,涉及铝盐的水解、胶体的用途、铁盐的氧化性、工业上制硝酸和氯碱工业的反应原理等。

练习册系列答案
相关题目
下列实验中,依据实验操作及现象,得出的结论正确的是( )
| | 操作 | 现象 | 结论 |
| A. | 用食醋浸泡水垢。[水垢成分: CaCO 3与Mg(OH)2] | 水垢溶解,有无色气泡 | 碱性:CH3COONa>Na2CO3 |
| B. | 浓硫酸与氯化钠固体微热 | 产生刺激性气味气体 | 酸性:H2SO4>HCl |
| C. | 向FeCl2溶液中通入过量Cl2 | 溶液由浅绿色变成黄色 | 还原性: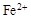 > >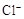 |
| D. | 向盛有1mL 0.1mol/LNaCl 溶液的试管中滴加2~4滴 0.1mol/LAgNO3溶液,后继续 滴加1mL 0.1mol/LKI溶液。 | 先出现白色沉淀,后变 成黄色沉淀 | 溶解度:AgI>AgCl |
甲、乙、丙、丁4种物质均为只含有两种元素的化合物,其分于中均含有18个电子,下列说法中正确的是
| A.若气体甲的水溶液在常温下的PH<7,则甲一定为HCl |
| B.若乙的摩尔质量与O2相同,则乙一定为N2H4 |
| C.若3.0g的丙的物质的量为0.lmol,则丙一定为甲烷的同系物 |
| D.若丁为四原子分子,则丁一定能使品红溶液褪色 |
类比推理是重要的学科思想,下列根据已知进行推理正确的是
| 选项 | 已知 | 类比推理 |
| A | Na与O2共热生成Na2O2 | H2与O2共热生成H2O2 |
| B | S、Se属于VIA族元素 | Se的氧化物类似S有SeO2、SeO3 |
| C | 常温下,浓硝酸使铁钝化 | 浓硝酸与铜不反应 |
| D | NaOH溶液能溶解Al(OH)3 | 过量NH3·H2O缓慢溶解Al(OH)3 |
下列有关实验现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 N2O4的△H<0 N2O4的△H<0 |
| D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀变为黄色 | 溶度积:AgI比AgCl更小 |
下列说法正确的是
| A.往沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,可制得Fe(OH)3胶体 |
B.CO2溶于水中,只存在平衡:CO2+H2O H2CO3 H2CO3 |
| C.在潮湿的空气中,生铁比纯铁更耐腐蚀 |
| D.实验室可用浓H2SO4制备HCl,这是因为H2SO4的酸性比HCl强 |
向100mL18mol/L的硫酸中加入足量铜片,加热并充分反应。下列有关说法正确的是
| A.充分反应后转移1.8mol电子 | B.H2SO4只作氧化剂 |
| C.若不加热应生成H2 | D.消耗的铜的质量一定少于57.6g |