题目内容
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| B | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有CO32-或HCO3- |
| C | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| D | 取久置的绿矾(FeSO4·7H2O)溶于水,加入KSCN溶液 | 溶液变为血红色 | 绿矾部分或全部被氧化 |
CD
解析试题分析:A、要加碱中和,再滴加银氨溶液,错误; B、无法排除SO32-或HSO3-,错误;
考点:考查离子的检验和性质等实验操作。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列由相关实验现象所推出的结论正确的是
| A.二氧化硫能漂白某些物质,说明它具有氧化性 |
| B.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
| C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
下列实验中,依据实验操作及现象,得出的结论正确的是( )
| | 操作 | 现象 | 结论 |
| A. | 用食醋浸泡水垢。[水垢成分: CaCO 3与Mg(OH)2] | 水垢溶解,有无色气泡 | 碱性:CH3COONa>Na2CO3 |
| B. | 浓硫酸与氯化钠固体微热 | 产生刺激性气味气体 | 酸性:H2SO4>HCl |
| C. | 向FeCl2溶液中通入过量Cl2 | 溶液由浅绿色变成黄色 | 还原性: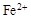 > >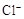 |
| D. | 向盛有1mL 0.1mol/LNaCl 溶液的试管中滴加2~4滴 0.1mol/LAgNO3溶液,后继续 滴加1mL 0.1mol/LKI溶液。 | 先出现白色沉淀,后变 成黄色沉淀 | 溶解度:AgI>AgCl |
右下图为与水相关的部分转化关系(水作反应物或生成物,部分产物和反应条件未列出)。下列说法错误的是
| A.右图所示的反应均为氧化还原反应 |
| B.比较镁、铁与水的反应条件,可知铁的金属性比镁弱 |
| C.工业上常用NO2与水的反应原理制取硝酸 |
| D.实验室中可用铜与稀硝酸反应制取NO2 |
S、N、Cl都是重要的非金属元素,下列说法正确是
| A.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49% |
| B.SO32-、ClO-、NO3-三种离子在溶液中因发生氧化还原反应而不能大量共存 |
| C.浓硫酸、硝酸具有强氧化性,浓硝酸和浓盐酸易分解具有不稳定性 |
| D.标况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA个(NA为阿伏加德罗常数) |
下列叙述正确的是
| A.CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
| B.铜片加入氯化铁溶液中发生反应:3Cu+2Fe3+=3Cu2++2Fe |
| C.FeCl2、Fe(OH)3、Cu2S均可通过化合反应制得 |
| D.在pH=1溶液中,NH4+、K+、ClO-、Cl-可以大量共存 |
甲、乙、丙、丁4种物质均为只含有两种元素的化合物,其分于中均含有18个电子,下列说法中正确的是
| A.若气体甲的水溶液在常温下的PH<7,则甲一定为HCl |
| B.若乙的摩尔质量与O2相同,则乙一定为N2H4 |
| C.若3.0g的丙的物质的量为0.lmol,则丙一定为甲烷的同系物 |
| D.若丁为四原子分子,则丁一定能使品红溶液褪色 |
向100mL18mol/L的硫酸中加入足量铜片,加热并充分反应。下列有关说法正确的是
| A.充分反应后转移1.8mol电子 | B.H2SO4只作氧化剂 |
| C.若不加热应生成H2 | D.消耗的铜的质量一定少于57.6g |